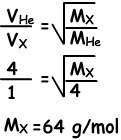Effusion und Diffusion von Gasen mit Beispielen
Effusion und Diffusion von Gasen mit Beispielen
Diffusion:
Das Mischen von Molekülen eines Gases mit Molekülen eines anderen Gases wird Diffusion genannt. Der Geruch eines Parfums oder einer Mahlzeit in einem Raum sind einige gebräuchliche Beispiele für die Diffusion von Gasen. Gase haben unterschiedliche Diffusionsraten bei unterschiedlichen Temperaturen. Die folgende Formel zeigt das Verhältnis der Diffusionsraten von zwei Gasen bei derselben Temperatur.
Die Diffusionsrate (r) ist direkt proportional zur mittleren Molekülgeschwindigkeit. 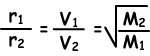
Wo; r1 und r2 sind Diffusionsraten von Gas 1 und Gas 2, V1 und V2 sind durchschnittliche Molekulargeschwindigkeiten von Gasen und M1 und M2 sind Molekularmassen von Gasen.
Die oben angegebene Gleichung wird auch “Grahams Diffusionsgesetz” genannt.
Nun geben wir das Diffusionsverhältnis von zwei verschiedenen Gasen bei unterschiedlichen Temperaturen an. Sei T1 and T2 die absolute Temperatur von Gasen. 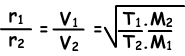
Um zusammenzufassen;
Geschwindigkeit der Gasdiffusion;
- ist umgekehrt proportional zur Quadratwurzel der Molmasse
- ist direkt proportional zur Quadratwurzel der absoluten Temperatur
Somit;
Wenn Gase die gleiche Temperatur haben, hat eines von ihnen mit kleinerer Molmasse eine größere Diffusionsrate. Wenn Gase die gleiche Molmasse haben, hat eines von ihnen mit höherer Temperatur eine größere Diffusionsrate.
Effusion 
Wie Sie auf dem obigen Bild sehen können, wird die Bewegung der Gase von einem Behälter zum anderen durch ein kleines Loch als Erguss bezeichnet (wie auf dem Bild gezeigt, ist der zweite Behälter im Allgemeinen leer oder Vakuum). Die Diffusion findet unter konstantem Druck statt, im Gegensatz dazu findet das Effundieren unter Druckdifferenz zwischen Behältern statt. Die Effusionsraten von Gasen ändern sich gemäß dem Grahamschen Diffusionsgesetz. Jetzt lösen wir einige Beispiele im Zusammenhang mit der Diffusion und dem Ausströmen von Gasen.
Beispiel: Wenn die Gase X und SO2 gleichzeitig von den Punkten A und B ausgestoßen werden, treffen sie sich an einem Punkt, der 20 cm von B entfernt ist. Welche der folgenden Aussagen ist richtig? (SO2 = 64)
I. Die Molmasse von X ist 4
II. Wenn wir die absolute Temperatur von SO2 erhöhen und die Temperatur von X konstant halten, nähert sich der Treffpunkt der Gase A an.
III. Wenn wir die absoluten Temperaturen von Gasen um die gleiche Menge senken, ändert sich der Treffpunkt nicht. 
Lösung:
I. Da der Treffpunkt der Gase 20 cm von B entfernt ist, bewegen sich die Moleküle von X viermal schneller als die Moleküle von SO2. 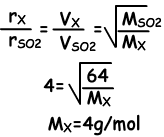
I. ist wahr
II. SO2 bewegt sich langsamer als X, wenn wir die Temperatur von SO2 erhöhen, erhöht sich seine Geschwindigkeit und der Treffpunkt rückt näher an Punkt A. II ist ebenfalls wahr.
III. Sinkende Temperaturen von Gasen in gleicher Menge haben keinen Einfluss auf den Treffpunkt. III ist wahr
Beispiel: Welche der folgenden Aussagen gilt für die durchschnittliche Molekülgeschwindigkeit von H2- und N2-Molekülen? (H = 1, N = 14)
I. N2-Moleküle sind bei 40 ° C langsamer als H2-Moleküle bei 40 ° C.
II. H2-Moleküle sind bei 80 ° C langsamer als N2-Moleküle bei 40 ° C.
III. N2-Moleküle sind bei 80 ° C schneller als H2-Moleküle bei 40 ° C.
Lösung:
Molmasse von H2 = 2 g / mol, Molmasse von N2 = 28 g / mol.
I. Da die Molmasse von N2 größer als H2 ist, bewegen sich die Moleküle von N2 langsamer als H2. Ich bin wahr
II. Die durchschnittliche Molekülgeschwindigkeit ist direkt proportional zur Quadratwurzel der absoluten Temperatur. Somit sind Moleküle von H2 schneller als Moleküle von N2. II ist wahr
III. N2-Moleküle sind bei 80 ° C schneller als H2-Moleküle bei 40 ° C. III ist wahr.
Beispiel: Bei konstanter Temperatur treffen sich beim Öffnen der Hähne die Gase am Punkt A. Ermitteln Sie die Molekularmasse von X (Gas).
Lösung:
Da sie sich am Punkt A treffen, sind He-Moleküle schneller als X-Moleküle. Während er 4 Einheiten Abstand nimmt, nimmt X 1 Einheit Abstand.