Verdünnung und Dichte der Lösungen
Verdünnung und Dichte der Lösungen
Bei der Verdünnung wird Lösungsmittel zur Lösung gegeben. Da die Menge des gelösten Stoffes konstant bleibt, nimmt die Konzentration der Lösung ab. Wir finden die Beziehung zwischen der Konzentration der Lösungen vor und nach der Verdünnung mit der folgenden Formel:
M1.V1=M2.V2
Dabei ist M1 die anfängliche Molarität und M2 die endgültige Molarität und V1 und V2 sind anfängliche und endgültige Lösungsvolumina.
Um die Konzentration der Lösungen zu erhöhen, sollten Sie gelösten Stoff hinzufügen oder das Lösungsmittel aus der Lösung abdampfen. Die oben angegebene Formel wird auch zur Erhöhung der Konzentration von Lösungen verwendet;
M1.V1=M2.V2
Die Konzentration von Lösungen und Volumina ist umgekehrt proportional zueinander. Wenn das Lösungsvolumen zunimmt, nimmt die Molarität der Lösung ab. Die unten angegebene Grafik zeigt diese Beziehung.

Beispiel: Wenn wir zu einer 0,2 molaren 300 ml-Lösung 700 ml Wasser mit der gleichen Temperatur geben, ermitteln Sie die endgültige molare Konzentration dieser Lösung.
Lösung:
M1=0,2 molar, V1=300=0,3 mL
V2=300+700 =1000mL=1 L
M1.V1=M2.V2
0,2.0,3=M2.1
M2=0,06 molar
Beispiel: Wenn wir die im Bild angegebenen Lösungen mischen, ermitteln Sie die Konzentration der endgültigen Lösung.

Lösung: Die Summe der Massen von Lösung eins und zwei ergibt die Masse der endgültigen Lösung
m1+m2=mfinale
80 + 40 =120 g
Die Summe der gelösten Massen eins und zwei ergibt die Masse des endgültigen gelösten Stoffes.
(1) mZucker1 + mZucker2=mZuckerf
Wir finden Massen von gelösten Stoffen durch;
mZucker1=m1.20/100=80.1/5=16 g
mZucker2=m2.30/100=40.30/100=12 g
mZuckerf=mfinale.X/100=120.X/100 g
wir verwenden Gleichung (1) und lösen für X;
mZucker1 + mZucker2=mZuckerf
16 + 12=120.X/100 g
28=12.X/10
X=23,3
Dichte der Lösungen
Wir finden die Lösungsdichte nach folgender Formel; 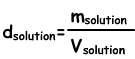
Einheit der flüssigen Lösungen g / ml oder g / cm3. Wenn wir den gelösten Stoff in Wasser geben, bereiten wir die Lösung vor. Wenn wir gelösten Stoff zu der Lösungsdichte hinzufügen, nimmt dieser zu, da die Zunahme der Lösungsmasse größer ist als die Zunahme des Volumens. In Fest-Flüssig-Lösungen nimmt die Dichte mit zunehmender Lösungskonzentration zu.
Beispiel: Die Dichte der H2SO4-Lösung mit 49 Masseprozent beträgt 1,2 g / ml. Finden Sie die molare Konzentration dieser Lösung. (H2SO4 = 98)
Lösung:
Dichte der Lösung = 1,2 g / ml
Massenprozent = 49%
Die Molmasse von H2SO4 beträgt 98 g
Wir finden die molare Konzentration der Lösung mit der folgenden Formel; 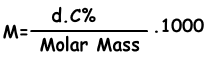
M=(1,2.4)/98 . 1000
M=6 molar
Beispiel: Die Löslichkeit von X bei 15 oC beträgt 20 g X / 100. Welche der folgenden Aussagen gilt für Lösungen, die mit 30 g X und 120 g Wasser bei 15 oC hergestellt wurden?
I. Lösung ist gesättigt.
II. Die Masse der Lösung beträgt 150 g.
III. Die Massenkonzentration beträgt 20%.
Lösung:
I. bei 15 ° C
100 g Wasser lösen 20 g X auf
120 g Wasser löst sich auf? g X
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯
? = 24 g X wird gelöst.
da 30 g X zu 120 g Wasser gegeben werden, ist die Lösung gesättigt und 30-24 = 6 g X bleiben ungelöst. Ich bin wahr
II. Die Masse der Lösung entspricht der Summe aus gelöstem Stoff und Lösungsmittel.
m = m(gelöster Stoff)+ m(Lösungsmittel) m=120+24=144
Somit ist Masse ungleich 150 g, II ist falsch.
III. Da sich 100 g Wasser in 20 g X auflösen, liegen auch 20 g X in 120 g Lösung vor. Also Massenprozent;
X% = (mX / mLösung) .100
X% = (20/120) .100 = 16,7
III ist falsch