Reaktionsgeschwindigkeiten (chemische Kinetik)
Reaktionsgeschwindigkeiten (chemische Kinetik)
Physikalische, chemische und nukleare Reaktionen finden mit unterschiedlicher Geschwindigkeit statt. Die chemische Rate ist die Änderungsmenge der Materie in der Zeiteinheit.
Reaktionsgeschwindigkeiten = (Änderung der Materiemenge) / Zeit
∆ [A (g)] ist die Darstellung der Änderung der Molarität von A-Gas. Die Reaktionsgeschwindigkeit kann für alle Aspekte der Reaktion angegeben werden.
Beispiel:
N2(g) + 3H2(g) → 2NH3
Die Reaktionsgeschwindigkeiten für N2, H2 und NH3 sind nachstehend angegeben.
Reaktionsgeschwindigkeit von N2 = - ∆ [N2 (g)] / ∆t
Reaktionsgeschwindigkeit von H2 = - ∆ [H2 (g)] / ∆t
Reaktionsgeschwindigkeit von NH3 = ∆ [NH3 (g)] / ∆t
Das “-” Zeichen vor N2 und H2-Gasen zeigt, dass diese Stoffe bei der Reaktion verwendet werden und das NH3-Zeichen positiv ist, da es bei der Reaktion entsteht. Eine chemische Reaktion hat natürlich eine Reaktionsgeschwindigkeit. Die folgende Gleichung zeigt die Reaktionsgeschwindigkeit in Bezug auf Produkte und Reaktanten.
aA + bB → cC + dD
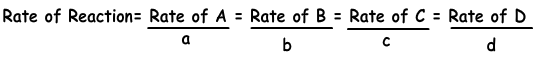
Wenn wir die Reaktionsgeschwindigkeit für NH3 schreiben;
Reaktionsgeschwindigkeit = Geschwindigkeit von N2/1 = Geschwindigkeit von H2/3 = Geschwindigkeit von NH3/2
Wie wir zuvor angegeben haben, können wir die Reaktionsgeschwindigkeit wie folgt definieren:
Reaktionsgeschwindigkeiten = (Änderung der Materiemenge) / Zeit
Beispiel: Die Elektrolyse von 18 g Wasser dauert 10 Minuten. Finden;
I. Bildungsrate von H2
II. Bildungsrate von O2
III. Verbrauchsrate von H2O
Lösung:
Bildungsrate von H2 = + 2/10 = 0,2 g / Minute
Bildungsrate von O2 = + 16/10 = 1,6 g / Minute
Verbrauchsrate von H2O = -18 / 10 = - 1,8 g / Minute
Aktivierungsenergie
Es ist die Energie, die benötigt wird, um eine chemische Reaktion zu starten. Reaktionen mit höherer Aktivierungsenergie haben eine geringere Reaktionsgeschwindigkeit. Aktivierungsenergie kann nur durch Katalysatoren verändert werden. Sie verringern die Aktivierungsenergie der Reaktion und erhöhen die Reaktionsgeschwindigkeit.

MnO2 ist der Katalysator dieser Reaktion.
Faktoren, die die Reaktionsgeschwindigkeit beeinflussen
- Arten von Angelegenheiten in Reaktion
- Konzentrationen und physikalische Aggregatzustände in Reaktion
- Temperatur
- Druck und Volumen
- Katalysatoren
- Kontaktfläche
Beispiel: Welche der folgenden Aussagen sollte gemacht werden, um die Geschwindigkeit der Bildung von CO2 Gas in der folgenden Reaktion zu erhöhen.
C (s) + O2 (g) → CO2 (g)
I. Herstellung von C (s) Pulver
II. O2 (g) in den Behälter geben
III. CO2 Gas in Behälter einfüllen
Lösung:
Um die Reaktionsgeschwindigkeit zu erhöhen, die Materie gasförmig zu machen, die Temperatur zu erhöhen, das Volumen zu verringern und Katalysatoren zu verwenden, sollte die Kontaktfläche erhöht werden. Andererseits beeinflusst die Zugabe von Reaktanten die Reaktionsgeschwindigkeit nicht.