Reaktionsgeschwindigkeiten (Chemische Kinetik) Spickzettel
Reaktionsgeschwindigkeiten (Chemische Kinetik) Spickzettel
Reaktionsgeschwindigkeiten (chemische Kinetik) Physikalische, chemische und nukleare Reaktionen finden mit unterschiedlicher Geschwindigkeit statt. Die chemische Rate ist die Änderungsmenge der Materie in der Zeiteinheit.
Reaktionsgeschwindigkeiten = (Änderung der Materiemenge) / Zeit ∆ [A (g)] ist die Darstellung der Änderung der Molarität von A-Gas. Die Reaktionsgeschwindigkeit kann für alle Aspekte der Reaktion angegeben werden.
Die folgende Gleichung zeigt die Reaktionsgeschwindigkeit in Bezug auf Produkte und Reaktanten.
aA + bB → cC + dD
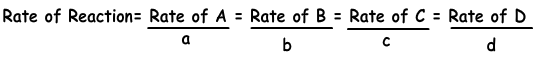
Aktivierungsenergie
Es ist die Energie, die benötigt wird, um eine chemische Reaktion zu starten. Reaktionen mit höherer Aktivierungsenergie haben eine geringere Reaktionsgeschwindigkeit. Aktivierungsenergie kann nur durch Katalysatoren verändert werden. Sie verringern die Aktivierungsenergie der Reaktion und erhöhen die Reaktionsgeschwindigkeit. 
MnO2 ist der Katalysator dieser Reaktion.
Faktoren, die die Reaktionsgeschwindigkeit beeinflussen
1. Arten von Materie in Reaktion:
- Im Allgemeinen weisen Reaktionen mit Reaktanten und Produkten in Gasphasen eine höhere Reaktionsgeschwindigkeit auf als Reaktionen, die aus Substanzen in flüssiger Phase bestehen.
- Zu viele Bindungen zu lösen und neue zu bilden, verlangsamt die Reaktion.
- Reaktionen, die aus Ionen mit entgegengesetzten Vorzeichen bestehen, weisen eine hohe Reaktionsgeschwindigkeit auf.
2. Konzentration von Gegenständen:
Die Kollisionstheorie ist die erfolgreichste, die chemische Reaktionen erklärt. Teilchen müssen kollidieren, um miteinander zu reagieren. Im Gegenteil, nicht alle Kollisionen führen zu Reaktionen.
- Fragen sollten Energie benötigt haben, um zu reagieren.
- Die Partikel sollten in geeigneter Geometrie kollidieren, um zu reagieren.
Der Zusammenhang zwischen Stoffkonzentrationen und Reaktionsgeschwindigkeit kann wie folgt erklärt werden:
aA + bB → cC + dD
Die Reaktionsgeschwindigkeit dieser Reaktion wird gefunden durch:
Reaktionsgeschwindigkeit = k.[A]a.[B]b
Wo; k ist die Geschwindigkeitskonstante oder der Geschwindigkeitskoeffizient, der von der Temperatur abhängt, und a und b sind Exponenten.
Reihenfolge der Reaktion;
Die Reihenfolge der Reaktion ist die Summe der Exponenten. Zum Beispiel;
Reaktionsgeschwindigkeit = k. [A]2.[B].[C]3 Ordnung dieser Reaktion ist 2 + 1 + 3 = 6.
3. Temperatur in Reaktionen:
Wenn die Temperatur um 10 ° C ansteigt, steigt die Reaktionsgeschwindigkeit. Wenn wir die Temperatur erhöhen;
- Anzahl der Kollisionen in der Zeiteinheit erhöht
- Die Anzahl der Teilchen, deren Energie über der Aktivierungsenergie liegt, nimmt zu.
4. Katalysatoren:
Katalysatoren sind Substanzen, die die Reaktionsgeschwindigkeit erhöhen oder verringern und sich bei der Reaktion nicht verändern.
5. Oberfläche der Reaktanten:
Wenn die Partikelgröße klein ist, nimmt die Oberfläche zu. Erhöhen Sie die Reaktionsgeschwindigkeit, indem Sie die Oberfläche der Reaktanten erhöhen.