Chemisches Gleichgewicht
Chemisches Gleichgewicht
Bisher haben wir gelernt, dass Reaktionen in eine Richtung stattfinden. Aber jetzt beschäftigen wir uns mit reversiblen Reaktionen. Die unten angegebene Reaktion findet in einem geschlossenen Behälter statt.
A(g) + B(g) → C(g) + D(g)
Zu Beginn reagiert A mit B und erzeugt C und D Gas. Dies ist eine Vorwärtsreaktion, und die Geschwindigkeit dieser Reaktion wird wie folgt geschrieben:
Reaktionsgeschwindigkeit = kf.[A].[B]
Da die Konzentrationen von A und B mit der Zeit abnehmen, nimmt auch die Vorwärtsreaktionsrate ab. Darüber hinaus kollidieren produzierte C und D Moleküle miteinander und bilden A- und B-Moleküle. Dies nennt man Umkehrreaktion, und die Geschwindigkeit wird wie folgt geschrieben:
Reaktionsgeschwindigkeit = kr.[C].[D]
Die Konzentrationen von C und D Gasen nehmen mit der Zeit zu und A und B ab. An einem Punkt werden die Reaktionsgeschwindigkeiten der Vorwärts- und Rückwärtsreaktion gleich und die Reaktion erreicht das Gleichgewicht. Wir schreiben diese Gleichungen wie;
kf.[A].[B] = kr.[C].[D]
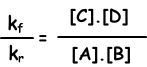
kf / kr = Gleichgewichtskonstante und in Bezug auf die Konzentration mit Kc dargestellt. Die Gleichgewichtskonstante der folgenden Reaktion wird geschrieben als;
aA + bB ↔ cC + dD
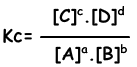
Die Gleichgewichtsgleichung wird aus der Gesamtreaktion geschrieben. Es handelt sich nicht um Reaktionsschritte wie bei Einrichtungsreaktionen. Reaktionen müssen folgenden Regeln folgen, um ein Gleichgewicht zu erreichen;
- System muss geschlossen sein
- Die Temperatur muss konstant sein
- Die Reaktion muss reversibel sein
Wenn sich die Temperatur ändert, können die Reaktionsgeschwindigkeiten in Vorwärts- oder Rückwärtsrichtung geändert werden und das System erreicht kein Gleichgewicht. Wenn die Reaktion nicht reversibel ist, können wir nicht über das Gleichgewicht sprechen. Schließlich sind geschlossene Systeme erforderlich, um einen Materialverlust während der Reaktion zu verhindern. Jetzt lernen wir, warum Systeme dazu neigen, ein Gleichgewicht zu erreichen.
- Alle Systeme wollen ihre Energie reduzieren. Es ist die Tendenz zu minimaler Energie.
- Alle Systeme neigen dazu, ihre Störung zu erhöhen. Es wird als Tendenz der maximalen Störung bezeichnet.
Wasser in einem offenen Behälter verdunstet mit der Zeit. Flüssiges Wasser hat eine geringere Energie als gasförmiges Wasser und befolgt das Mindestenergiegesetz. Im Gegenteil, die Verdampfung kann durch das Gesetz der maximalen Störung erklärt werden. Flüssige Wassermoleküle verwandeln ihre Phase in Gas und verstärken ihre Störung.
Störung von;
Gas> Lösungen> Flüssigkeit> Feststoff
Energie von;
Gas> Flüssigkeit> Feststoff
P.S:
Die Auflösung von Feststoffen und Flüssigkeiten ist exotherm oder endotherm. Die Auflösung von Gasen ist jedoch immer exotherm.
Beispiel: Welche der folgenden Reaktionen können exotherm sein?
I. 2HI(g) ↔ H2(g) + I2(g)
II. 2NH3(g) ↔ N2(g) + 3H2(g)
III. CO2(g) ↔ CO2(aq)
IV. CaCO3(s) ↔ CaO(s) + CO2(g)
V. N2O4(g) ↔ 2NO2(g)
Lösung: I-, II- und V-Reaktionen befinden sich alle in der Gasphase. Störung nimmt in der Produktrichtung zu. Diese Reaktionen sind also endotherm. In Reaktion IV ändert der Feststoff die Phase und wird zu Gas. Da die Störung von der festen in die Gasphase zunimmt, ist diese Reaktion endotherm. In Reaktion III nimmt die Störung von Produkten zu Reaktanten zu und die Reaktion ist exotherm.
Homogenes und heterogenes Gleichgewicht
Wenn sich alle in der Gleichgewichtsreaktion befindlichen Stoffe in einer Phase befinden, handelt es sich um ein homogenes Gleichgewicht. Wenn mindestens einer der Stoffe eine andere Phase aufweist, handelt es sich um ein heterogenes Gleichgewicht.
Wenn wir die Gleichgewichtsgleichung des heterogenen Gleichgewichts schreiben, schreiben wir in die Gleichgewichtsgleichung keine reinen festen und reinen flüssigen Stoffe. Zum Beispiel;
2NH3(g) ↔ N2(g) + 3H2(g)
Reaktion ist homogene Reaktion und wir schreiben alle Angelegenheiten zur Gleichgewichtsgleichung.
CaCO3(s) ↔ CaO(s) + CO2(g)
Diese Reaktion ist eine heterogene Gleichgewichtsreaktion und wir schreiben CaCO3(s) und CaO (s) nicht in die Gleichgewichtsgleichung.
Gleichgewichtskonstante in Bezug auf Partialdruck
Gaskonzentrationen sind direkt proportional zum Partialdruck von ihnen. Somit können wir eine Gleichgewichtskonstante in Form von Partialdrücken schreiben.
N2(g) + 3H2(g) ↔ 2NH3(g)
Die Gleichgewichtskonstante dieser Reaktion in Bezug auf die Konzentrationen ist;
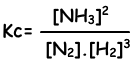
Die Gleichgewichtskonstante dieser Reaktion in Bezug auf den Partialdruck ist;
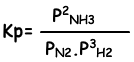
Die Beziehung zwischen diesen beiden Gleichgewichtskonstanten ist;
Kp=Kc(R.T)∆n
∆n= ∑nReaktanten - ∑nProdukte
Zum Beispiel:
N2(g) + 3H2(g) ↔ 2NH3(g)
seit ∆nProdukte=2 (2 mol NH3) und ∆nreactants=4 (1 mol N2 und 3 mol H2)
∆n= -2
Kp=Kc.(R.T)-2