Fases (estados) de Materia con el ejemplo
Fases (Estados) de la materia con ejemplos
Materia puede existir en cuatro estados: sólido, líquido y gaseoso y plasma. Algunas de las propiedades específicas de estas fases se dan en la tabla de abajo.

En esta unidad vamos a examinar los sólidos, líquidos y gases. Forma dada a continuación se resumen los cambios de fase de los asuntos de sólido a líquido, líquido a gas.
![]Fases (Estados) de la materia(/images/matters/phase_change.png)
Ganando calor en tres fases de la materia aumento promedio energías cinéticas de las partículas. De la materia misma de la energía cinética de las partículas en la fase gas es mayor que la energía cinética en los estados sólido y líquido. Definiciones de algunos conceptos relacionados con el cambio de fase son los siguientes.
Fusión: la materia cambia de estado sólido a líquido.
Congelación: proceso inverso de la fusión se denomina punto de congelación. Materia líquida pierde calor y cambia su estado a sólido.
Ebullición: asuntos líquido ganancia de calor y cambiar sus estados de gas.
Condensación: proceso inverso de la ebullición se llama condensación. Las moléculas de gas pierden calor y el cambio en su fase de líquido.
Durante el cambio de fase, la temperatura de los asuntos se mantienen constantes. Los gráficos de cambio de fase son los siguientes.
Gráfico de la temperatura en función del tiempo de calefacción sustancia sólida pura es la siguiente.

En los intervalos I. III. y V. temperatura de los aumentos de la materia. Dado que la materia es pura energía, cinética de la que también aumenta. Podemos encontrar calor ganado en estos intervalos, con la siguiente fórmula;
Q=m.c.ΔT
donde, m es la masa, c es la capacidad de calor específico y la ΔT es el cambio en la temperatura (Tfinal-Tinicial)
En los intervalos II. y IV. temperatura de la materia permanece constante porque la materia está cambiando de fase. Dado que la temperatura de la materia es constante, la energía cinética de la misma también es constante. Por el contrario, durante el cambio de fase, las distancias entre el aumento de las moléculas, por lo tanto la energía potencial de la materia también se incrementa. En estos intervalos, tenemos una mezcla heterogénea, por ejemplo en el intervalo II. tenemos sólidos + mezcla de líquido y en el intervalo IV. tenemos mezcla de líquidos de gas +. Nos encontramos con el calor necesario en estos intervalos, con las siguientes fórmulas:
Q=m.Lfusión or Q=m.Lvaporización
calor, donde m es la masa, Lfusión es latente de fusión y Lvaporization es el calor latente de vaporización.
La pérdida de calor de la materia en la fase de gas tiene una temperatura vs tiempo como el gráfico a continuación.

Como se puede ver en los dos gráficos de punto de ebullición se convierte en punto de condensación y punto de fusión se convierte en punto de congelación en el proceso de enfriamiento. Sus magnitudes son iguales. Nosotros usamos las mismas fórmulas dadas arriba para encontrar el calor liberado por la materia durante este proceso.
Resolvemos algunos ejemplos relacionados con el cambio de fase.
Ejemplo: Buscar el calor necesario para aumentar la temperatura de 100 g de hielo a partir de 00C a 40 0C (cwater = 1cal/g0C, Lfusión = 80cal / g)
Solución:
Nos derretir el hielo, luego el calor a 40 0C.
Q1=m.Lfusión
Q1=100g.80.cal/g
Q1=8000 cal
Ahora que el aumento de temperatura de 0 a 400C
Q2=m.c.ΔT
Q2=100.1.(40-0)
Q2=4000cal
Qtotal=Q1+Q2=8000cal+4000cal=12000cal.
Ejemplo: Si mezclamos dos aguas con 150 g de masa y la temperatura de 400C y 800C y 100 g, encontrar la temperatura final de las mezclas (cagua = 1cal/g.0C).
Solución:
Cuando dos cuestiones que tienen diferentes temperaturas están en contacto, hay una transferencia de calor entre ellos. El calor fluye de la materia que tiene una temperatura más alta a la materia que la temperatura baja hasta que la misma temperatura. El calor obtenido es siempre igual a la pérdida de calor.
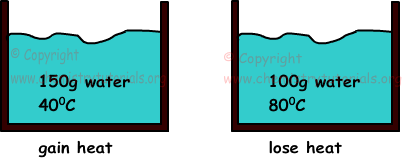
la temperatura de la mezcla final debe estar entre las temperaturas de las aguas tanto
400C<Tfinal<800C
Qgained=Qlost
m1.c1.ΔT1=m2.c2.ΔT2
150.1.(T-40)=100.1.(80-T)
T=560C
Materia y propiedades de la Materia exámenes y soluciones a los problemas