La polaridad de los Bonos
Polaridad de los Bonos
En los bonos, que se forman entre dos átomos iguales, los electrones son atraídos por fuerzas iguales. Llamamos a estos enlaces covalentes no polares . H2, O2 y N2 tiene un enlace covalente no polar. Si se forma un enlace covalente entre dos átomos diferentes que tienen electronegatividad diferente, entonces la fuerza que actúa sobre electrones compartido por los átomos se vuelve diferente. Este tipo de bonos se llaman enlaces covalentes polares. De HCl, HF, CO, son ejemplos de enlace covalente polar . Las moléculas que tienen enlaces polares puede ser polar o no polar. Para tener una idea acerca de si molécula es polar o no polar que usted debe buscar en la geometría de molécula.
La hibridación y la geometría de unión
Hemos aprendido que los átomos pueden formar enlaces de igual número de medias orbitales llenos. Por el contrario, cuando nos fijamos en la geometría de molécula o número inesperado de los bonos de II A, III y IV los grupos A, lo explicamos con otro concepto que se conoce como hibridación. Ahora vamos a examinar cada uno de los elementos del grupo y su capacidad de unión con la ayuda de este concepto.
Que los Bonos del Grupo:
Elemento de Li es un ejemplo de grupo de IA, permítanme examinar enlace entre los átomos de Li y H.
Electron configuración de Li es;
Li: 1s22s1
Como se puede ver Li tiene una órbita llena hasta la mitad y se puede formar un enlace. Por lo tanto comparten Li y H un electrón y forma después de fianza;
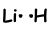
Esta molécula es lineal y polar.As se puede adivinar todas las moléculas de diatomeas son lineales.
II Un grupo de Bonos: (hibridación sp)
Sea elemento de este grupo de forma enlaces con H y F; BeH2 y BeF2 . Configuración electrónica del Be es;
Be: 1s22s2
Como puede observarse en la configuración electrónica, Be no tiene la mitad de los orbitales llenos. Esperamos que no puede formar enlace. En los experimentos realizados en contra de este espectáculo que la hibridación que ser forman enlaces.
Si bien la formación de enlace, un electrón en el orbital 2s transferido a los orbitales 2p y Ser tiene dos orbitales medio llenos y tienen capacidad para formar 2 enlaces. Dado que los electrones están en orbitales diferentes (2s y 2p), esperamos que sus propiedades son diferentes. Por el contrario, los experimentos demuestran que estos bonos tienen mismas características, que son los mismos. Esto también se explica con la hibridación.
Estos orbitales se repelen entre sí y colocados con un ángulo de 180 0 entre sí y la forma después de enlaces;
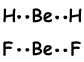
Esta molécula es lineal y no polar. Los bonos son polares, sino fuerza equivalente actuando en Sea con 180 0 ángulo es cero, por lo molécula es no polar.
Un Grupo III Bonos: (sp2 hibridación)
Elemento 5B en este grupo de forma enlaces con H y F; BeH3 y BeF3. Configuración electrónica de B es;
B: 1s22s22p1
Como se ve desde la configuración de electrones, B tiene un medio lleno orbital y pueden formar una unión. Pero wee ver de que forma 3 enlaces. Este es un ejemplo de hibridación sp2. Un electrón del orbital 2s se transfiere al orbital 2p y tiene ahora 3 orbitales y medio llenos y pueden formar tres bonos. Estos tres enlaces son mismo de nuevo como en el caso de la hibridación sp y por repeler entre sí se encuentran con 120 0 y ángulo. Se demuestra que estos electrones y los bonos con la fórmula de puntos de Lewis;
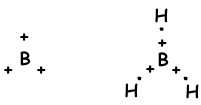
Molécula tiene una geometría plana trigonal. Esta molécula es también polar, a pesar de todos los bonos son polares. Como los electrones se colocan con un ángulo de 120 0, la fuerza equivalente de ellos es cero, por lo molécula es no polar.
Un Grupo IV Bonos: (hibridación sp3)
Elemento de 6C en este grupo de forma enlaces con H y F, CH4 y CF4. Electron configuración de C es;
C: 1s22s22p2
Como puede observarse en la configuración electrónica, C tiene dos orbitales medio llenos y puede formar dos enlaces. Pero wee ver de que forma 4 enlaces. Este es un ejemplo de hibridación sp3. Un electrón del orbital 2s se transfiere al orbital 2p y tiene ahora 4 orbitales y medio llenos y pueden formar 4 enlaces ahora. Estos cuatro enlaces son mismo de nuevo como en el caso de la hibridación sp y sp2 y por repeler entre sí se encuentran con 1090 y el ángulo . Se demuestra que estos electrones y los bonos con la fórmula de puntos de Lewis;
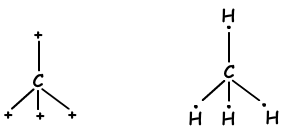
Estas moléculas tienen forma tetraédrica y son moléculas no polares.
V los Bonos del grupo: (hibridación sp3)
Elemento 7N en este grupo de forma enlaces con H; NH3. Electron configuración de N es;
N: 1s22s22p3
Al observar la estructura orbital de este elemento, se dice que puede formar 3 enlaces y no hay necesidad de hibridación. Por el contrario, los experimentos realizados en este programa elemento que, la hibridación debe producirse a tener 1070 ángulo entre enlaces. Por lo tanto, uno 2s y tres orbitales 2p se mezclan y cuatro sp3 orbital híbrido. Uno de estos orbitales tienen 2 electrones y no unirse a la unión, pero cambia el ángulo en el caso de tetraédrica 1090 -1070 y forma nueva forma “piramidal trigonal”. Como las cargas no se distribuyen equitativamente esta molécula es polar. Forma de NH3 bonos;
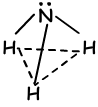
VI los Bonos del grupo: (hibridación sp3 )
8O elemento en este grupo de forma lazos con H y F, H2O y OF2. Electron configuración de O es;
O: 1s22s22p4
El oxígeno puede formar dos enlaces, pero los experimentos muestran que el ángulo entre los bonos es del 104,5 0, esto sólo será posible con la hibridación. Uno s y 3 orbitales p se mezclan y 4 orbitales híbridos sp se forman. Estos cuatro orbitales contienen 6 electrones y 2 de los orbitales se llena hasta la mitad y se forman 2 enlaces. Forma de la molécula se dobla y la molécula es polar.
Ejemplo: En el que uno de los compuestos siguientes, tanto molécula y enlaces son polares.
(4Be, 5B, 6C, 8O, 16S, 17Cl)
I. BeCl2
II. CO2
III. SCl2
IV. BCl3
V. CCl4
Solución:
I. Lewis fórmula de puntos de BeCl2 se indica a continuación;

Forma de la molécula es lineal, y es no polar.
II. De puntos de Lewis fórmula de CO2 es la siguiente;
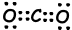
Forma de la molécula es lineal, y es no polar.
III. De puntos de Lewis fórmula de SCl2 se indica a continuación;
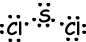
Vector de unión resultante no es cero. Por lo tanto, la molécula es polar y los bonos también son polares.
IV. De puntos de Lewis fórmula de BCl3 se indica a continuación;
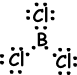
Forma de la molécula es plana trigonal. Como el vector enlace resultante es cero molécula es no polar.
V. de puntos de Lewis fórmula de CCl4 se indica a continuación;
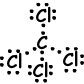
Forma de la molécula es tetraédrica, y la molécula es no polar.
Por lo tanto, los bonos y la estructura de la molécula de SCl2 son polares.