Estructura atómica con ejemplos
Estructura atómica con ejemplos
Átomo es la partícula más pequeña de la materia. Consta de tres partículas, llamadas protones, electrones y neutrones. Los protones y los neutrones se colocan en el centro del átomo y los electrones se colocan alrededor del centro. Cuadro que se presenta a continuación muestra, la estructura del átomo y la ubicación de neutrones protones y electrones en el átomo.
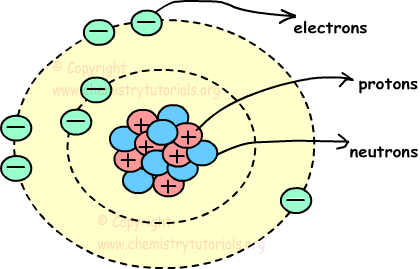
Centro del átomo, como los protones y neutrones, es llamado también el núcleo y los círculos alrededor del núcleo se llaman órbitas.
Protones: Los protones son partículas con carga positiva de los átomos. Están situados en el núcleo, y tienen masa. Mostramos los protones con la letra “p”.
Electrones: Los electrones son partículas negativamente cargadas en movimiento de los átomos. Se encuentran alrededor del núcleo en órbitas, y no tienen masa. Mostramos los electrones con la letra “e”.
Neutrones: Los neutrones son partículas de menos de carga de los átomos. Están situados en el núcleo, y tienen masa. Mostramos los neutrones con la letra “n”.

Número atómico:
El número atómico indica el número de protones en cada átomo. Es específico para cada átomo y se muestra con la letra “Z”. En el número de átomos neutros de protones es igual al número de electrones. Por lo tanto;
Z = p = e
El número atómico se escribe;
atómica numberX
Número de masa:
Masa del neutrón es aproximadamente igual a la masa del protón. Descuidamos la masa del electrón, ya que es demasiado pequeño. Por lo tanto, la masa de un átomo es igual a la suma de la masa de los protones y los neutrones. Se muestra el número de masa con la letra “M”. Número de masa no es específica para cada átomo. Diferentes átomos pueden tener mismo número de masa.
M=n+p
Mostramos M en el átomo como;
ZMX
isótopos:
Los isótopos tienen el mismo número atómico, pero el número de masa diferente. Esto significa que los átomos tienen el mismo número de protones pero distinto número de neutrones. Dado que el número de protones son iguales, las propiedades químicas de los átomos son los mismos, y puesto que el número de neutrones son diferentes propiedades físicas de los átomos son diferentes. Los isótopos de hidrógeno se indican a continuación;
11H,
12H ,
13H
isótonos:
Isótono átomos tienen el mismo número de neutrones y un número diferente de protones.
De sodio y el magnesio son los átomos isótono, su número de neutrones son iguales.
1123Na y 1224Mg
isobaras:
Isobar átomos tienen diferente número atómico y el número de neutrones diferentes, pero mismo número de masa.
1124Na y 1224Mg
Dado que el número de protones y neutrones número de átomos son diferentes, sus propiedades físicas y químicas también son diferentes.
Ejemplo: ¿Cuál de las siguientes declaraciones son las mismas para los átomos de los isótopos.
I. El número de protones
II. Número de neutrones
III. Número de electrones
IV. número atómico
V. Características químicas
VI. Propiedades físicas
Los isótopos tienen el mismo número atómico fresa diferente número de masa. Esto significa que, los átomos de los isótopos tienen el mismo número de protones y distinto número de neutrones. Si el átomo es neutro luego el número de protones en el átomo es el número de electrones igual yo. Dado que el número de protones de los átomos son iguales y el número de neutrones son diferentes, las propiedades químicas de estos átomos son los mismos pero las propiedades físicas de ellos son diferentes. Por lo tanto;
I. III. IV. y V es cierto para los átomos de los isótopos.
Ejemplo: Encontrar el número de protones del átomo que tiene número de masa 65 y el número de neutrones 35.
Número de masa es igual a la suma de protones y neutrones.
M=p+n
65=35+p
p=30
Ejemplo: ¿Cuáles de las siguientes afirmaciones son verdaderas para los ands 1224X y 1124Y átomos.
I. Número de protones X> Y
II. número de neutrones de Y es mayor que el número de neutrones de la X
III. Sus números de masa son iguales
1224X :
X tiene 12 protones y
24-12 = 12 neutrones
Número de masa = 24
1124Y:
Y tiene 11 protones y
24-11 = 13 neutrones
Número de masa = 24
Por lo tanto, I. II. y III. son verdaderas.
Ejemplo:
I. 2656Fe+2, 2656Fe+3
II. 2656Fe, 2756Co
III. H2O, D2O
Que una de las parejas ha dado por encima de las mismas propiedades químicas. (11H, 12D)
Tener las mismas propiedades químicas, deben tener el mismo número de protones y electrones.
I. Ambos tiene los mismos números de protones 26, pero su número de electrones son diferentes. Primero tiene 26-2 = 24 electrones y un segundo 26-3 = 23 electrones. Por lo tanto tienen diferentes propiedades químicas.
II. Ya que ambos tienen diferentes números de protones y electrones, que tienen diferentes propiedades químicas.
III. En esta pareja, que tienen el mismo número de protones y electrones tienen las mismas propiedades químicas.