Periodiek Systeem
Periodiek Systeem
Periodiek systeem is opgesteld voor het classificeren van elementen op basis van hun overeenkomsten in chemische en fysische eigenschappen. In deze tabel worden elementen gerangschikt naar oplopend atoomnummer. De algemene vorm van het periodiek systeem wordt hieronder gegeven. 
In het periodiek systeem ziet u atoomnummer, naam, symbool en massa aantal elementen. Zoals u in de bovenstaande afbeelding kunt zien, worden horizontale rijen periode genoemd en verticale kolommen groep. Er zijn 7 periodes en twee groepen A en B in het periodiek systeem. Groepen A en B hebben ook 8 subgroepen (8B heeft drie kolommen). In een periode veranderen eigenschappen van elementen van links naar rechts. In een groep hebben elementen vergelijkbare chemische eigenschappen.
Orbitalen In Periodiek Systeem
s blok: Dit blok bevat elementen met valentie-elektronen in s orbitaal. IA en IIA zijn s-blok groepen. Bijvoorbeeld,
1s22s22p63s1 en 1s22s2 zijn s blok elementen.
p-blok: Dit blok bevat elementen met valentie-elektronen in p-orbitalen. IIIA, IVA, VA, VIA, VIIA en VIII A zijn p-blokgroepen. Bijvoorbeeld,
1s22s22p63s23p5en 1s22s22p63s23p64s23d104p3 zijn p blok elementen.
d-blok: Dit blok bevat elementen met valentie-elektronen in d-orbitalen. IIIB, IVB, VB, VIB, VIIB, VIIIB, IB en IIB zijn d-blokgroepen. Twee elementen links onderaan behoren niet tot het d-blok. Bijvoorbeeld,
1s22s22p63s23p64s23d4 en 1s22s22p63s23p64s23d10 zijn d blok elementen.
d-blokelementen worden ook overgangselementen genoemd en ze zijn allemaal van metaal.
f-blok: dit blok bevat elementen met valentie-elektronen in f orbitalen. Twee elementen genoemd in d-blok (IIIB) en twee rijen getekend onderaan periodiek systeem behoren tot f-blok.
1s22s22p63s23p64s23d104p65s24d105p66s24f3 is een voorbeeld van f block element.
f-blokelementen worden ook innerlijke overgangselementen genoemd. Ze zijn verdeeld in twee groepen lanthaniden en actiniden.
Volg de periodieke tabel om blokken gedetailleerd weer te geven.
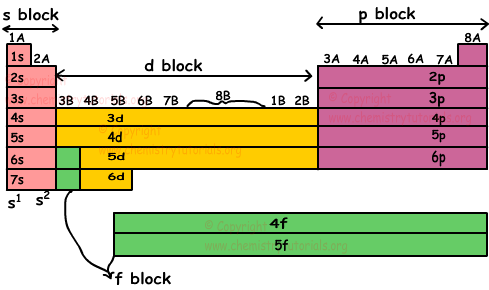
Lanthaniden z ijn elementen met een atoomnummer tussen 58 en 71. Actiniden zijn elementen met een atoomnummer tussen 90 en 103. s- en p-blokken worden hoofd groepen genoemd. De onderstaande lijst toont enkele belangrijke groepsnamen;
IA = alkalimetalen
IIA = Alkalische aardes
VIIA = Halogenen