Verdunning En Dichtheid Van Oplossingen
Verdunning En Dichtheid Van Oplossingen
Verdunning is het proces waarbij oplosmiddel aan de oplossing wordt toegevoegd. Omdat de hoeveelheid opgeloste stof constant blijft, neemt de concentratie van de oplossing af. We vinden een verband tussen de concentratie van oplossingen voor en na verdunning met de volgende formule;
M1.V1=M2.V2
Waar M1 initiële molariteit is en M2 uiteindelijke molariteit is en V1 en V2 initiële en uiteindelijke volumes oplossing zijn.
Om de concentratie van oplossingen te verhogen, moet u opgeloste stof toevoegen of oplosmiddel uit de oplossing verdampen. De hierboven gegeven formule wordt ook gebruikt bij het verhogen van de concentratie van oplossingen;
M1.V1=M2.V2
Concentratie van oplossingen en volumes zijn omgekeerd evenredig met elkaar. Als het volume van de oplossing toeneemt, neemt de molariteit van de oplossing af. Onderstaande grafiek toont deze relatie; 
Voorbeeld: Als we 700 ml water bij dezelfde temperatuur toevoegen aan 0,2 molaire 300 ml oplossing, zoek dan de uiteindelijke molaire concentratie van deze oplossing.
Oplossing: M1=0,2 molaire, V1=300=0,3 mL
V2=300+700 =1000mL=1 L
M1.V1=M2.V2
0,2.0,3=M2.1
M2=0,06 molaire
Voorbeeld: Als we oplossingen mengen die in de onderstaande afbeelding worden weergegeven, zoek dan de concentratie van de uiteindelijke oplossing.

Oplossing: Som van massa-oplossing één en twee geeft ons een massa uiteindelijke oplossing
m1+m2=mlaatste
80 + 40 =120 g
Som van opgeloste massa’s één en twee geeft ons massa van uiteindelijke opgeloste stof.
(1) msuiker1 + msuiker2= msuikerl
We vinden massa’s opgeloste stoffen door;
msuiker1=m1.20/100=80.1/5=16 g
msuiker2=m2.30/100=40.30/100=12 g
msuiker1=mlaatste.X/100=120.X/100 g
we gebruiken vergelijking (1) en lossen op voor X;
msuiker1 + msuiker2= msuikerl
16 + 12=120.X/100 g
28=12.X/10
X=23,3
Dichtheid Van Oplossingen
We vinden de dichtheid van oplossingen door de volgende formule te volgen; 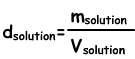
Eenheid vloeibare oplossingen g / ml of g/cm3. Door opgeloste stof in water te brengen, bereiden we de oplossing voor. Wanneer we opgeloste stof toevoegen aan de oplossingsdichtheid ervan neemt toe, omdat de toename in de massa van de oplossing groter is dan de toename in volume. In vaste-vloeibare oplossingen neemt de dichtheid toe met het toenemen van de concentratie van de oplossing.
Voorbeeld: De dichtheid van H2SO4 oplossing, met een massapercentage van 49%, is 1,2 g / ml. Zoek de molaire concentratie van deze oplossing. (H2SO4 = 98)
Oplossing:
dichtheid van oplossing = 1,2 g / ml
Massapercentage = 49%
De molecuulmassa van H2SO4 is 98 g
We vinden een molaire concentratie van oplossing met de volgende formule; 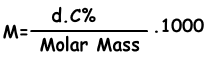
M=(1,2.4)/98 . 1000
M=6 molaire
Voorbeeld: Oplosbaarheid van X bij 15 oC is 20 g X / 100. Welke van de volgende beweringen zijn waar voor oplossingen bereid met 30 g X en 120 g water bij 15 oC?
I. Oplossing is verzadigd.
II. De massa van de oplossing is 150 g.
III. Concentratie massapercentage is 20%
Oplossing:
I. bij 15 ° C
100 g water lost 20 g X op
120 g water lost op? g X
-——————————-
?=24 g X is opgelost.
omdat 30 g X wordt toegevoegd aan 120 g water, is de oplossing verzadigd en blijft 30-24 = 6 g X onopgelost. I is waar.
II. De massa van de oplossing is gelijk aan de som van opgeloste stof en oplosmiddel.
m = mopgeloste + moplosmiddel
m=120+24=144
De massa is dus niet gelijk aan 150 g, II is onwaar.
III. Omdat 100 g water 20 g X oplost, is er ook 20 g X in een oplossing van 120 g. Aldus massaprocent; X %=(mX/mOplossing).100
X %=(20/120).100=16,7
III is fout