Reactiesnelheid (Chemische Kinetiek)
Reactiesnelheid (Chemische Kinetiek) Fysieke, chemische en nucleaire reacties. Chemische snelheid is de hoeveelheid verandering in de materie in tijdseenheid.
Reactiesnelheid = (verandering in hoeveelheid materie) / tijd
Δ[A (g)] is de weergave van de verandering in molariteit van A gas. Reactiesnelheid kan worden geschreven voor alle zaken in de reactie.
Voorbeeld: N2(g) + 3H2(g) → 2NH3
Reactiesnelheidvan N2, H2 en NH3 wordt hieronder gegeven;
Reactiesnelheid van N2= - Δ[N2(g)]/Δt
Reactiesnelheid van H2= - Δ[H2(g)]/Δt
Reactiesnelheid van NH3= Δ[NH3(g)]/Δt
“-” teken voor N2en H2gasen tonen aan dat deze worden gebruikt in reactie en teken van NH3. Een chemische reactie heeft natuurlijk één reactiesnelheid. De volgende vergelijking toont de reactiesnelheid in termen van producten en reactanten.
aA + bB → cC + dD
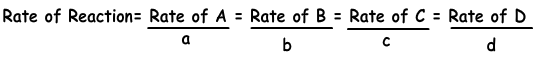
als we de reactiesnelheid voor NH3 schrijven;
Reactiesnelheid = Snelheid van N2 / 1 = Snelheid van H2 / 3 = Snelheid van NH3/ 2
Zoals we eerder geven, kunnen we de reactiesnelheid definiëren als;
Reactiesnelheid = (verandering in hoeveelheid materie) / tijd
Voorbeeld: Elektrolyse van 18 g water duurt 10 minuten. Finder;
I. Vormingssnelheid van H2
II. Vormingssnelheid van O2
III. Consumptiesnelheid van H2O
Oplossing:
Vormingssnelheid van H2 = +2/10=0,2 g / minuut
Vormingssnelheid van O2 = +16/10=1,6 g / minuut
Snelheid van verbruik H2O = -18/10= - 1,8 g / minuut
Activeringsenergie
Het is de energie die nodig is om een chemische reactie te starten. Reacties met hogere activeringsenergie. Activeringsenergie kan alleen worden gewijzigd door katalysatoren. Ze verminderen de activering van energie en verhogen de reactiesnelheid.
MnO2 is de katalysator van deze reactie.
Factoren Die De Reactiesnelheid Beïnvloeden
- Soorten zaken die reageren
- Concentraties en fysieke toestanden van reacties in reactie
- temperatuur
- Druk en volume
- katalysatoren
- Contactoppervlak
Voorbeeld: Welke van de volgende beweringen moeten worden gedaan om de snelheid van vorming van CO2 gas in de volgende reactie te verhogen.
C(s) + O2(g) → CO2(g)
I. C (s) poeder maken
II. O2 (g) toevoegen aan de container
III. Toevoegen van CO2 gas in een container
Oplossing: Om de reactiesnelheid te verhogen, zaken tot gas te maken, de temperatuur te verhogen, het volume te verlagen, het gebruik van katalysatoren, moet het contactoppervlak worden vergroot. Anderzijds heeft het toevoegen van reactanten geen invloed op de reactiesnelheid.