Cheatsheet Reactiesnelheid (Chemische Kinetiek)
Cheatsheet Reactiesnelheid (Chemische Kinetiek)
Reactiesnelheid (Chemische Kinetiek) Fysieke, chemische en nucleaire reacties. Chemische snelheid is de hoeveelheid verandering in de materie in tijdseenheid.
Reactiesnelheid = (verandering in hoeveelheid materie) / tijd
Δ [A(g)] is de weergave van de verandering in molariteit van A gas. Reactiesnelheid kan worden geschreven voor alle zaken in de reactie. De volgende vergelijking toont de reactiesnelheid in termen van producten en reactanten.
aA + bB → cC + dD
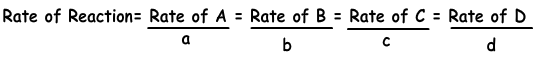
Activeringsenergie
Het is de energie die nodig is om een chemische reactie te starten. Reacties met hogere activeringsenergie. Activeringsenergie kan alleen worden gewijzigd door katalysatoren. Ze verminderen de activering van energie en verhogen de reactiesnelheid. 
MnO2 is de katalysator van deze reactie.
Factoren die de Reactiesnelheid Beïnvloeden
1. Soorten Materie Die Reageert:
- In het algemeen hebben reacties met reactanten en producten in gasfasen een hogere reactiesnelheid dan reacties die bestaan uit stoffen in vloeibare fase.
- Door te veel banden te verbreken en nieuwe te vormen, vertraagt de reactie.
- Reacties die bestaan uit ionen met tegengestelde tekens hebben een hoge reactiesnelheid.
2. Concentratie Van Zaken In Reactie:
Botsingstheorie is de meest succesvolle die de chemische reactie verklaart. Deeltjes moeten botsen om op elkaar te reageren. Integendeel, alle botsingen leiden niet tot een reactie.
- Zaken hadden energie nodig moeten hebben om te reageren.
- Deeltjes moeten in de juiste geometrie botsen om te reageren.
Het verband tussen concentraties van zaken en reactiesnelheid kan worden verklaard als;
aA + bB → cC + dD
Reactiesnelheid van deze reactie wordt gevonden door;
Reactiesnelheid = k. [A]a[B]b
Waar; k is de snelheidsconstante of snelheidscoëfficiënt die afhankelijk is van de temperatuur en a en b zijn exponenten.
Volgorde Van De Reactie;
Volgorde van reactie is de som van exponenten. Bijvoorbeeld;
Reactiesnelheid = k. [A]2.[B].[C]3 volgorde van deze reactie is 2+1+3=6.
3.Temperatuur In Reacties:
Toename van de temperatuur met ongeveer 10 ° C resulteert in toename van de reactiesnelheid. Wanneer we de temperatuur verhogen;
- aantal botsingen in tijdseenheid neemt toe
- aantal deeltjes met energie boven activeringsenergie neemt toe.
4. Katalysatoren:
Katalysatoren zijn zaken die de reactiesnelheid verhogen of verlagen en die niet worden gewijzigd in de reactie.
5. Oppervlakte Van Reagentia:
Als deeltjes klein zijn, neemt het oppervlak ervan toe. Toenemend oppervlak van de reactanten, verhoogt de reactiesnelheid.