Cheatsheet Voor Chemische Bindingen
Cheatsheet Voor Chemische Binding en Bindingen
Het bij elkaar houden van atomen en moleculen wordt binding genoemd. Als binding atomen samenbindt, noemen we het chemische binding . Als binding moleculen echter samenbindt, noemen we het moleculaire binding . Chemische Bindingen:
Er zijn twee soorten chemische bindingen;
- Ionbinding
- Covalente binding
Representaties van het valentie-elektron rond het symbool van elementen met stippen. Bijvoorbeeld;
11Na=1s22s22p63s1
Zoals je kunt zien, heeft Na één valentie-elektron in zijn buitenste schil. We tonen het met de Lewis-formule;
Na ●
Het is de band tussen positief en negatief geladen ionen. Metalen en niet-metalen atomen komen samen met ionische binding. Metaalatoom verliest elektron en wordt positief geladen en niet-metalen atoom accepteert elektron en wordt negatief geladen. Krachten bij elkaar houden is elektrostatisch aantrekkelijke kracht. 2. Covalente Binding:
Als atomen hun valentie-elektronen delen tijdens het bindingsproces, noemen we het covalente binding. Er is geen elektronenoverdracht. Dit type binding wordt gezien tussen twee of meer niet-metalen atomen. Om covalente binding te hebben, moeten atomen ten minste een half gevulde orbitaal hebben. Covalente binding tussen H2 molecuul wordt hieronder getoond; 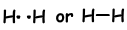
In bindingen, die zich vormen tussen twee hetzelfde atoom, worden elektronen aangetrokken door gelijke krachten. We noemen deze obligaties niet-polaire covalente bindingen . Als een covalente binding wordt gevormd tussen twee verschillende atomen met verschillende elektronegativiteit, wordt kracht die op de gedeelde elektron werkt door de atomen anders. Dit soort bindingen worden polaire covalente bindingen genoemd.
Hybridisatie en Bonding Geometrie
We hebben geleerd dat atomen bindingen kunnen vormen die gelijk zijn aan het aantal halfgevulde orbitalen. Integendeel, als we kijken naar molecuulgeometrie of onverwacht aantal bindingen van II A-, III A- en IV A-groepen, leggen we dit uit met een ander concept dat hybridisatie wordt genoemd.
sp hybridisatie
sp2 hybridisatie
sp3 hybridisatie
- Lineair
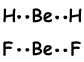
- Trigonale Vlakke
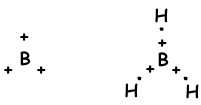
- Tetraedrische
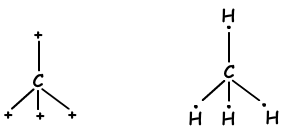
- Trigonale piramidale
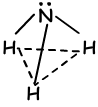
- Krom (gebogen)
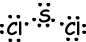
Bond die metaalatomen bij elkaar houdt, wordt metaalbinding genoemd.
Atomen gebonden met covalente bindingen produceren moleculen en deze moleculen trekken elkaar aan en vormen secundaire bindingen. We onderzoeken deze obligaties onder drie titels, Vander Waals Bond, Dipole-Dipole Interactions en Hydrogen Bond.
1) Van der Waals Binding:
We zien deze bindingen in moleculen met% 100 niet-polaire bindingen zoals I2, Cl2, H2 en moleculen met polaire bindingen maar niet-polaire moleculen zoals CO2. Wanneer niet-polaire moleculen zoals CO2 dichterbij komen, stoten ze elkaar af en wordt de symmetrie van de molecule verbroken. En dan worden positieve en negatieve dipolen gevormd in een molecuul. Een directe aantrekkingskracht van deze dipolen op elkaar wordt Van der Waals binding genoemd.
2) Dipole-Dipole Interactie:
Dit soort binding wordt gezien tussen polaire moleculen in vaste en vloeibare fasen zoals HCl, SO2, H2S, PH3. Omdat er geen symmetrie is in polaire moleculen, zijn er polen met negatieve en positieve ladingen. De aantrekkingskracht tussen deze polen in moleculen wordt dipool-dipool interactie genoemd.
3) Waterstofbindingen:
Chemische bindingen gevormd tussen H en atomen met een hoge elektronegativiteit zoals F, NO zijn sterker dan dipool-dipool interacties. We kunnen dit verklaren;
Omdat O een hoge elektronegativiteit heeft, trekt het H in H-O-binding sterk aan en deze bindingen worden waterstofbinding genoemd. Met andere woorden, aantrekking tussen H-atoom van het ene molecuul en O-atoom van een ander molecuul wordt waterstofbinding genoemd.
Ionische vaste stoffen:
Covalent vaste stoffen:
Moleculaire vaste stoffen:
Metallische vaste stoffen: