Gassen Examen 1 En Probleem Oplossingen
Gassen Examen 1 En Probleem Oplossingen
1. Welke van de volgende waarheden zijn waar volgens de kinetische gastheorie;
I. Snelheid van gasdeeltjes is gelijk bij dezelfde temperatuur.
II. Afstotende of aantrekkingskrachten tussen gasmoleculen zijn te klein om te verwaarlozen
III. Toenemende temperatuur verhoogt de gemiddelde kinetische energie van gassen.
Oplossing:
I. Snelheid van gasdeeltjes is omgekeerd evenredig met de gasmassa en rechtstreeks evenredig met de temperatuur. De snelheid van alle gasdeeltjes is dus niet gelijk aan elkaar. I is fout.
II. Omdat er een grote hoeveelheid ruimte tussen gasdeeltjes is, is afstoting of aantrekkingskracht tussen deze deeltjes te klein en kunnen ze worden verwaarloosd. II is waar.
III. Gemiddelde kinetische energieën van gassen zijn recht evenredig met de temperatuur. III is waar.
2. Het hieronder gegeven systeem is gevuld met X-vloeistof onder 0 ° C en 70 cm Hg atmosferische druk. Als de dichtheid van X kleiner is dan Hg en de buis een doorsnede heeft van 1 cm2, zoek dan uit welke van de volgende beweringen waar is voor dit systeem. 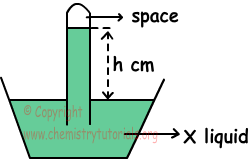
I. h> 70 cm
II. Als we een buis gebruiken met een doorsnede van 2 cm2, verandert de h-waarde.
III. Als we dit systeem op zeeniveau zetten, neemt h toe.
Oplossing:
I. Atmosferische druk is;
hcm.X = 70 cm Hg
H en dichtheid van vloeistof in buis is omgekeerd evenredig met elkaar. Zo;
dX 70cm Hg, I is waar.
II. Doorsnede van buis heeft geen invloed op h-waarde. II is fout.
III. Atmosferische druk op zeeniveau is 76 cm Hg, dus de systeemdruk neemt toe en ook de h neemt toe. III is waar.
3. Door een van de volgende omstandigheden gedraagt gas zich als ideaal gas?

Oplossing:
Gassen gedragen zich als ideaal gas wanneer hun temperatuur stijgt en de druk afneemt. In gegeven gassen is 300 ° C de hoogste temperatuur en is de kleinste druk 1 atm. II gedraagt zich als ideaal gas ten opzichte van andere omstandigheden.
4. Welke van de volgende uitspraken zijn waar gerelateerd aan gemiddelde moleculensnelheden van H2 en N2 gassen?
I. N2 (g) bij 40 ° C is langzamer dan H2 (g) bij 40 ° C
II. H2 (g) bij 80 ° C is langzamer dan N2 (g) bij 40 ° C
III. N2 (g) bij 80 ° C is sneller dan N2 (g) bij 40 ° C
Oplossing: Molaire massa H2 is 2 g / mol en molaire massa N2 is 28 g / mol.
I. Bij dezelfde temperatuur is de moleculaire snelheid omgekeerd evenredig met de vierkantswortel van molaire massa’s. Omdat de molmassa van N2 groter is dan H2, is de snelheid van N2 moleculen langzamer dan de snelheid van H2 moleculen. I is waar.
II. De gemiddelde moleculaire snelheid is recht evenredig met de vierkantswortel van temperatuur. Omdat de temperatuur van H2 hoger is dan N2 en de molaire massa van H2 kleiner is dan N2, is de moleculaire snelheid van H2 moleculen groter dan de moleculaire snelheid van N2moleculen. II is fout.
III. Omdat de moleculaire snelheid direct evenredig is met de temperatuur, heeft N2 bij 80 ° C een grotere moleculaire snelheid dan N2 bij 40 ° C. III is waar.
5. Vind een waarde van 0,5 atm in termen van cm Hg.
Oplossing:
We weten dat er een verband is tussen atm en cm Hg; 1 atm = 76 cm Hg =760 mm Hg
1 atm is 76 cm Hg
0,5 atm is ? cm Hg
-—————————
?=38 cm Hg