Закон об идеальном газе
Закон об идеальном газе
идеальный газ; молекулы не имеют объема и между ними нет взаимодействия. На самом деле такого газа нет, это всего лишь предположение. Все реальные газы имеют небольшие объемы, и между ними есть взаимодействия. В решении проблем; мы считаем все газы идеальным газом. Ниже приведено уравнение идеального газа. Мы получаем это, комбинируя все газовые законы, приведенные в предыдущем разделе.
P.V = n.R.T
Где; Давление P, объем V, количество частиц n, газовая постоянная R 0,08206 л атм / K моль или 22,4 / 273 л атм / K моль, и температура T
Теперь для лучшего понимания мы решаем некоторые проблемы, связанные с законом об идеальном газе, внимательно следим за каждым примером.
Пример: Найти давление 8,8 г CO2 при 27 ° С в контейнере объемом 1230 см3. (С = 12, О = 16)
Решение: Сначала мы находим молярную массу CO2;
CO2 = 12 + 2,16 = 44
Затем мы находим моли CO2;
n = 8,8 / 44 = 0,2 моль
Преобразование температуры от 0C до К и объема от см3 до литра; T=27+273=300 K
V = 1230 см3 = 1,23 литра
Теперь мы используем закон идеального газа, чтобы найти неизвестное количество.
P.V = n.R.T
P.1,23 = 0,2.0,08206.300
P = 4 атм
Пример: Найти молярную массу Х (газа), приведенную на рисунке ниже, имеющую объем 896 см3, температуру 273 ° С и массу 0,96 г. (O = 16, а атмосферное давление 1 атм) 
Решение:
Мы делаем преобразования единиц в первую очередь.
P = 38 см Hg = 38/76 = 0,5 атм
V = 896/1000 = 0,896 литров
Т = 273 + 273 = 546 К
Теперь мы используем закон идеального газа, чтобы найти n;
P.V = n.R.T
0,5.0,896 = п. (22,4 / 273) 0,546
n = 0,03 моль
Молярная масса X;
MX=mX / п = 0,96 / 0,03
MX= 32 г / моль
Таким образом, Х (газ) = O2
Пример: Приведенная ниже система расположена в месте с атмосферным давлением 70 см ртутного столба. В контейнере сначала 2 г He, затем мы добавляем в этот контейнер 1 г газа H2. Найдите повышение Hg в манометре после добавления H2. (He=4, H2=2)

Pначальная = P0-20 = 70-20 = 50 см рт.ст.
Pначальная = 2/4 = 0,5 моль He
nH2 = 1/2 = 0,5 моль H2
nконечная=nHe+nH2
nконечная = 0,5 + 0,5 = 1 моль
Мы пишем закон идеального газа для начальных и конечных значений, а затем перебрасываем их друг в друга, чтобы найти неизвестное значение.
V и T постоянны в двух ситуациях. 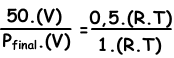
Пфинал = 100 см рт. Ст.
Разница между уровнями ртути между двумя ветвями манометра;
100-70 = 30 см в правой ветви манометра
Таким образом, разница между начальным и конечным уровнями ртути становится;
20 + 30 = 50 см
Это изменение разделено на две ветви манометра;
50/2 = 25 см
Таким образом, Hg поднимается на 25 см в одной ветви манометра.