Химические связи
Химические связи облигации
Сила, удерживающая атомы и молекулы вместе, называется «связью ». Атомы собираются вместе и становятся более стабильными, и энергия высвобождается во время этого процесса. Таким образом, можно сказать, что все реакции связывания являются экзотермическими. Наоборот, все реакции разрыва связей являются эндотермическими. Валентные электроны атомов и молекул играют роль в связывании. Если связь связывает атомы вместе, то мы называем это «химическая связь ». Однако, если связь связывает молекулы вместе, мы называем это «молекулярная связь ».
Химические связи:
Есть два типа химических связей;
- Ионная связь
- Ковалентная связь
Хотя элементы образуют соединения, они, как правило, имеют электронную конфигурацию благородных газов. За исключением He, все благородные газы заканчивают свою электронную конфигурацию с ns2np6. Другими словами, все оболочки благородных газов заполнены. Они слишком стабильны. Атомы также хотят быть стабильными и дополняют свое число валентных электронов до 8.
Льюис Структуры Атомов
Представления о валентном электроне вокруг символа элементов с точками. Например;
11Na=1s22s22p63s1
Как вы можете видеть, Na имеет один валентный электрон в своей внешней оболочке. Мы показываем это с формулой Льюиса;
Na●
С другой стороны, если орбитали 1s, 2s и 2p заполнены, то они не представлены формулой Льюиса.
Пример: 17Cl написать формулу Льюиса атома Cl.
17Cl=1s22s22p63s23p5
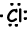
Валентные электроны ионов также могут быть представлены формулой Льюиса. Например;
Формула Льюиса 9F-1 является; 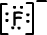
1. Ионная связь:
Это связь между положительно и отрицательно заряженными ионами. Металлы и неметаллические атомы соединяются вместе ионной связью. Атом металла теряет электрон и становится положительно заряженным, а неметаллический атом принимает электрон и становится отрицательно заряженным. Сила, удерживающая ионы вместе, является электростатической силой притяжения.
- В периодической таблице A металлы группы теряют электроны, равные их групповому номеру. Например; металлы в I A теряют 1 электрон и становятся +1 ионом, металлы в II A теряют 2 электрона и становятся +2 ионом, металлы в III A теряют 3 электрона и становятся +3 ионами.
- Неметаллы принимают электрон, который дополняет его валентные электроны до благородных газов. Например; неметаллы в группе V A принимают 3 электрона и становятся -3 ионами, неметаллы в группе VI A принимают 2 электрона и становятся -2 ионами, неметаллы в группе VII A принимают 1 электрон и становятся -1 ионами.
- В процессе ионной связи число принятых электронов равно числу потерянных электронов.
Пример: проанализировать связь между молекулой NaCl.
11Na теряет 1 электрон и становится Na+. 17Cl принимает один электрон и становится Cl-. Притяжение между противоположными ионами образует ионную связь.
- Сила ионной связи напрямую связана с тенденцией терять электрон металлов и принимать электрон неметаллов.
2. Ковалентная связь:
Если атомы делят свои валентные электроны в процессе связывания, мы называем это ковалентной связью. Там нет переноса электронов. Этот тип связи наблюдается между двумя или более неметаллическими атомами. Чтобы иметь ковалентную связь, атомы должны иметь хотя бы половину заполненной орбитали. Ковалентная связь между молекулой H2 показана ниже; 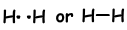
- Количество ковалентных связей равно числу наполовину заполненных орбиталей.
- Первая ковалентная связь между двумя атомами называется сигма-связью и обозначается “σ “.
- Существует только одна сигма-связь между двумя атомами, а другие связи называются пи-связями и обозначены «π ».
Пример: проанализировать связь между молекулой O2.
8O=1s22s22p4
Или показ с орбитальной и точечной схемой Льюиса;
Как видно из орбитальной схемы и точечной формулы Льюиса, O имеет две наполовину заполненные орбитали и может иметь две связи. Первая связь называется сигма и показана ниже;
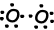
Эти атомы O разделяют свои вторые электроны и становятся молекулой O2;
Пример: показать ковалентные связи NH3.
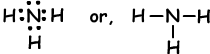
Пример: какое из следующих утверждений является ложным для элемента 8O.
I. Это неметалл
II. Это может сделать две связи
III. В основном состоянии электронная конфигурация имеет две заполненные орбитали
IV. I делаю ковалентную связь с 9F элементом.
V. Это делает ионную связь с 11Na и образует соединение; Na2O
Решение:
8O имеет электронную конфигурацию в основном состоянии; 
I. Поскольку число валентных электронов 8O равно 6, оно неметаллическое. Правда
II. Он имеет две наполовину заполненные орбиты, поэтому он может сделать две связи. Правда
III. Как видно из орбитальной схемы, 8O имеет 3 заполненных орбиты в основном состоянии. Ложь
IV. 9F имеет электронную конфигурацию в основном состоянии;
F: 1s22s22p5
F имеет 7 валентных электронов, и поэтому он неметаллический. Мы узнали, что два неметаллических атома соединяются ковалентной связью. Правда
V. 11Na имеет электронную конфигурацию в основном состоянии;
Na: 1s22s22p63s1
Na дает один электрон и становится Na+, а O принимает 2 электрона и становится O-2. Таким образом, связь между ними является ионной связью. Правда.