Химические связи рабочий лист
Химические связи рабочий лист
облигации
Сила, удерживающая атомы и молекулы вместе, называется «связью ». Если связь связывает атомы вместе, то мы называем это «химическая связь ». Однако, если связь связывает молекулы вместе, мы называем это «молекулярная связь ».
Есть два типа химических связей;
- Ионная связь
- Ковалентная связь
Льюис Структуры Атомов
Представления о валентном электроне вокруг символа элементов с точками. Например; 11Na=1s22s22p63s1
Как вы можете видеть, Na имеет один валентный электрон в своей внешней оболочке. Мы показываем это с формулой Льюиса;
Na●
1. Ионная связь:
Это связь между положительно и отрицательно заряженными ионами. Металлы и неметаллические атомы соединяются вместе ионной связью. Атом металла теряет электрон и становится положительно заряженным, а неметаллический атом принимает электрон и становится отрицательно заряженным. Сила, удерживающая ионы вместе, является электростатической силой притяжения.
2. Ковалентная связь:
Если атомы делят свои валентные электроны в процессе связывания, мы называем это ковалентной связью. Там нет переноса электронов. Этот тип связи наблюдается между двумя или более неметаллическими атомами. Чтобы иметь ковалентную связь, атомы должны иметь хотя бы половину заполненной орбитали. Ковалентная связь между молекулой H2 показана ниже; 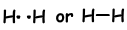
В связях, образующихся между двумя одинаковыми атомами, электроны притягиваются равными силами. Мы называем эти связи неполярными ковалентными связями. Если между двумя разными атомами, имеющими разную электроотрицательность, образуется ковалентная связь, то сила, действующая на общий электрон атомами, становится различной. Эти типы связей называются полярными ковалентными связями. Гибридизация и связующая геометрия Мы узнали, что атомы могут образовывать связи, равные числу наполовину заполненных орбиталей. Напротив, когда мы смотрим на геометрию молекулы или неожиданное количество связей групп II A, III A и IV A, мы объясняем это другой концепцией, которая называется гибридизацией.
sp-гибридизация sp2 -гибридизация
sp3- гибридизация
Молекулярные Формы
- линейный
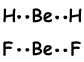
- треугольный планарный
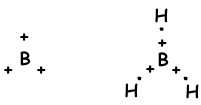
- четырехгранный
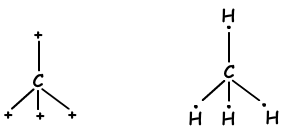
- треугольная пирамидальная
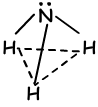
- изогнутый
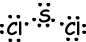
Связь, которая удерживает атомы металла вместе, называется «металлическая связь ».
Молекулярные связи
Атомы, связанные с ковалентными связями, производят молекулы, и эти молекулы притягивают друг друга и образуют вторичные связи. Мы исследуем эти связи под тремя названиями: связь Вандера-Ваальса, диполь-дипольные взаимодействия и водородная связь.
1) Облигации Ван-дер-Ваальса:
Мы видим эти связи в молекулах, имеющих 100% неполярных связей, таких как, I2, Cl2, H2, и молекулах, имеющих полярные связи, но неполярных молекул, таких как CO2. Когда неполярные молекулы, такие как СО2, становятся ближе, они отталкиваются друг от друга, и симметрия молекулы нарушается. И тогда в молекуле образуются положительные и отрицательные диполи. Мгновенное притяжение этих диполей друг к другу называется «связи Ван-дер-Ваальса ».
2) Диполь-дипольное взаимодействие:
Этот тип связи наблюдается между полярными молекулами в твердой и жидкой фазах, таких как HCl, SO2, H2S, PH3. Поскольку в полярных молекулах отсутствует симметрия, существуют полюса, имеющие отрицательный и положительный заряд. Притяжение между этими полюсами в молекуле называется «диполь-дипольное взаимодействие ».
3) Водородные связи:
Химические связи, образующиеся между Н и атомами, обладающими высокой электроотрицательностью, такими как F, N O, сильнее, чем диполь-дипольные взаимодействия. Мы можем объяснить это;
Поскольку О имеет высокую электроотрицательность, он сильно притягивает Н в связи Н-О, и эти связи называются «водородной связью ». Облигации в твердом состоянии:
1) Ионные твердые вещества
2) Ковалентные твердые вещества
3) Молекулярные твердые вещества
4) металлические твердые вещества