Атомная структура Экзамен 2 и решение проблем
Атомная структура Экзамен 2 и решение проблем
1. Какие из следующих соотношений относительно иона 714X-3 верны?
I. p+=n0
II. e->p+
III. Массовое число = p+ + e-
Решение:
Атомный номер = количество протонов = 7 p+=7
Массовое число=p+ + n0
14=7+n0
n0=7
n0=p+=7 I. правда
Находим заряд иона как;
заряд иона = p+ - e-
-3=7-e-
e-=10 (e->p+) II. правда
Массовое число 14, наоборот, сумма р + и е- 17
III. ложно
2. Положительно заряженные ионы называются катионами, а отрицательно заряженные ионы называются анионами. Таблица, приведенная ниже, показывает количество электронов и протонов данных элементов. 
Какие из приведенных выше элементов являются катионами?
Решение:
В нейтральном атоме число протонов равно числу электронов.
Количество протонов в X больше, чем число электронов, поэтому X является катионом.
Количество протонов Y равно числу электронов, поэтому Y нейтрален.
Количество протонов Z больше, чем число электронов, поэтому Z является катионом.
3. Если число электронов X+3, Y-3 и Z равно, какое из следующих утверждений верно для них.
I. X имеет самый большой ядерный заряд
II. Объем иона Y-3 больше, чем у других
III. Притяжение одного электрона; X+3> Z > Y-3
Решение:
Позвольте мне показать количество электронов с «а». Заряд ионов можно найти с помощью следующего уравнения;
заряд =p+-e-
Для X+3 иона;
+3 = p+ -a, тогда p+ = a + 3 и a+3X+3
Для иона Y-3;
-3 = p+ -a, тогда p+ = a-3 и a-3Y-3
Для атома Z;
p+=e-, тогда p+ = a и aZ0
Заряд ядра равен числу протонов. Итак, у Х самый большой заряд ядра. I. правда.
Поскольку у них одинаковое количество электронов, притяжение одного электрона прямо пропорционально числу протонов. Если число протонов возрастает, притяжение электронов также увеличивается. Таким образом, отношение становится;
X+3 > Z > Y-3 III. правда
Объем обратно пропорционален притяжению одного электрона.
X+3 < Z < Y-3 II. правда
4. Cu имеет два изотопа; 63Cu в 70% и 65Cl в 30%. Найти среднюю атомную массу атома Cu.
Решение:
Мы используем следующую формулу для определения средней атомной массы Cu; 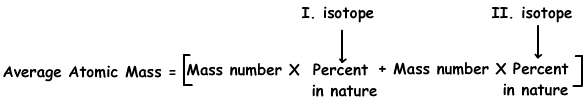
Средняя атомная масса Cu = 63. (70/100) + 65. (30/100)
Средняя атомная масса Cu = 63,6 г
5. Найти атомный номер элемента, который имеет электронную конфигурацию с 6p2.
Решение:
Чтобы найти атомный номер элемента, мы должны записать все орбитали до 6p2и суммарное количество электронов.
1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p2
Сумма числа электронов составляет 82. Таким образом, он также имеет 82 протонов и атомный номер 82.
6. Найдите количество заполненных и наполовину заполненных орбиталей элемента 14Si.
Решение:
Сначала запишем электронную конфигурацию 14Si, а затем покажем электроны на орбиталях. 14Si: 1s22s22p63s23p2
орбитали;
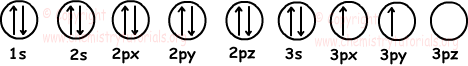
Как видно из приведенной диаграммы, 14Si имеет 6 заполненных и 2 наполовину заполненных орбиталей.