Атомная структура Экзамен 3 и решение проблем
Атомная структура Экзамен 3 и решение проблем
1. Есть ли сферическая симметрия в атоме 6C ?
Решение:
Электронная конфигурация С; C: 1s22s22p2
Поскольку в орбитали входят 2 электрона, сферическая симметрия в этом элементе отсутствует. Чтобы элементы сферической симметрии имели заполненные или наполовину заполненные орбитали.
2. Белый фосфор и красный фосфор являются аллотропом фосфорного элемента. Какие из следующих утверждений верны для них;
I. Электронные структуры атомов у них разные
II. Они имеют разные плотности
III. Химические свойства соединения P2O5, образованного этим аллотропом, различны.
Решение:
I. Аллотроп включает атомы, принадлежащие к одному элементу. Таким образом, электронные структуры атомов должны быть одинаковыми. I. ложно
II. Поскольку аллотропы имеют разные физические свойства, их плотность должна быть разной. II. правда.
III. Химические свойства аллотропа с другими элементами такие же. III. ложно
3. Какие из следующих пар имеют одинаковые химические свойства? (11H, 12D)
I. 2656Fe+2 и 2656Fe+3
II. 2656Fe и 2756Co
III. H2O и D2O
Решение:
Чтобы иметь одинаковые химические свойства, вещества должны иметь одинаковое количество протонов и электронов.
I. Поскольку у них одинаковое количество протонов, но разное количество электронов, их химические свойства различны.
II. Оба числа протонов и нейтронов различны. Итак, химические свойства у них тоже разные.
III. У них одинаковое количество протонов и электронов. Они имеют одинаковые химические свойства.
4. Какие из следующих утверждений ложны для атомов X и Y;
X: 1s22s22p63s1
Y: 1s22s22p63s23p64s1
I. Y - возбужденное состояние X
II. X и Y являются атомами одного и того же элемента
III. Y более устойчив, чем X
Решение:
I. Электронная конфигурация X записывается в соответствии с основным состоянием атома. Но в Y один электрон 3s записан в 4s орбитали. Таким образом, Y является возбужденным состоянием X. Если энергия отдается X, она может превратиться в Y. I. правда.
II. Поскольку у них обоих по 11 электронов, они принадлежат одному элементу. II.верно
III. Поскольку энергия X меньше энергии Y, она более стабильна, чем Y. III. ложно
5. Если число заполненных орбиталей X равно 7, а наполовину заполненных орбиталей равно 2, какие из следующих элементов можно найти?
I. Атомный номер
II. Количество валентных электронов
III. Массовое число
Решение:
Мы рисуем 7 заполненных и 2 наполовину заполненных орбиталей как; 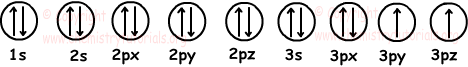
Электронная конфигурация :
1s22s22p63s23p4
Количество электронов: 2 + 2 + 6 + 2 + 4 = 16
В нейтральном атоме число электронов равно числу протонов и атомному номеру. Таким образом, используя данные, мы можем найти атомный номер элемента. Мы также можем найти валентные электроны элемента, добавив их.
3p и 3s - валентные орбитали.
Количество валентных электронов = 2 + 4 = 6
Мы должны знать количество нейтронов, чтобы найти массовое число. По приведенным данным мы не можем найти массовое число.
6. Какие из следующих утверждений верны для элементов 7X, 20Y и 18Z?
I. Y и X элементы образуют соединение YX2
II. Y и Z+1 ион изоэлектронные
III. Электронная конфигурация Z+1 последняя с 4s2 орбитальной.
Решение: 17X имеет электронную конфигурацию: 1s22s22p63s23p5
20Y имеет электронную конфигурацию: 1s22s22p63s23p64s2
X принимает один электрон, а Y дает два электрона, чтобы иметь электронную конфигурацию благородного газа. Х является неметаллом, а Y является металлом, они образуют следующее соединение;
YX2 I. правда
Поскольку электронная конфигурация Y и Z+1 различна, они не являются ни изоэлектронными. II. ложно
Z+1 имеет электронную конфигурацию: 1s22s22p63s23p5
III. ложно