Газовый экзамен 3 и решение проблем
Газовый экзамен 3 и решение проблем
1. Найти объем 0,5 моль CH4 при давлении 3,28 атм и температуре 400 0K.
Решение:
P = 3,28 атм, n = 0,5 моль, T400 0K, R = 0,082, V =?
Мы используем закон идеального газа; P.V=n.R.T
3,28.V=0,5.0,082.400
V = 5 литров
2. Если 6,4 г CH4 имеет давление 0,5 атм и объем 2 литра, найдите давление 9 г C2H6 объемом 1 литр при постоянной температуре (C = 12, H = 1).
Решение:
Сначала мы находим моль данных вопросов;
nCH4= 6,4 / 16 = 0,4 моль
nC2H6= 9/30 = 0,3 моль
Поскольку температура постоянна, мы пишем закон идеального газа, как указано ниже; 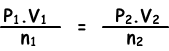
(0,5.2)/0,4=(P2.1)/0,3
P2=0,75 атм
or P2= 57 см рт. Ст.
3. Найти плотность O2 при температуре 27 0C и давлении 1,23 атм. (О = 16)
Решение:
Т = 27 + 273 = 300 0C
Если мы напишем закон идеального газа для плотности, мы получим следующее уравнение;
d = (p.m) / (комнатная температура)
где М - молярная масса O2.
d = (1,23.32) / (0,082.300)
d = 1,6g / литр
4. Если мы откроем краны, указанные на рисунке ниже, определим конечную температуру газов.
Решение:
Мы используем следующее уравнение, чтобы найти конечное давление газовой смеси; P1.V1 + P2.V2 + P3.V3 = Pfinal.Vfinal
3.2 + 4.3 + 0.5 =Pfinal.(2+3+5)
6 + 12=Pfinall.10
Pfinal=1,8 atm
5. Когда мы откроем краны, приведенные на рисунке ниже, обнаружим изменения в давлениях газов.

Решение:
Мы должны найти конечное давление системы, чтобы сделать сравнение.
P1.V1 + P2.V2 + P3.V3 = Pfinal.Vfinal
P.V + 2P.2V + 3P.V = Pfinal. (V + 2V + V)
Pfinal = 2P
Таким образом,
I. Давление первого увеличения контейнера
II. Давление второго контейнера остается постоянным
III. Давление третьего контейнера уменьшается