Газовый экзамен 4 и решение проблем
Газовый экзамен 4 и решение проблем
1. Найти плотность C4H8 при температуре 273 0C и давлении 2 атм. (H = 1, C = 12)
Решение:
Т = 273 + 273 = 546 0C
P = 2 атм и молярная масса C4H8 = 4. (12) + 8 (1) = 56 г / моль
Мы используем закон идеального газа, чтобы найти плотность газа;
P.MC4H8 = d.R.T
2,56 = d.0,082.546
d = 2,5G / л
2. Если сумма давлений 1,6 г Не и 0,8 г CH4 газ составляет 0,9 атм, найдите парциальные давления Не и CH4 (He = 4, C = 12, H = 1).
Решение:
Моли газов; nHe=1,6/4=0,4 моль
nCH4=0,8/16=0,05 моль
ntotal=0,4 + 0,05=0,45 моль
Парциальные давления газов определяются по формуле;
Px=(nx/ntotal).Ptotal
PHe=0,4/0,45,0,0=0,8 атм
PCH4=0,05/0,45.0,4=0,1 атм
3. В данном контейнере есть газ. Какие из следующих утверждений верны для этого контейнера при постоянной температуре?

I. Если мы добавим газ CH4 в контейнер, парциальное давление He увеличивается.
II. Если мы добавим O2 (г) в контейнер, плотность газов в контейнере возрастет.
III. Если мы добавим газ Ar в контейнер, средняя кинетическая энергия останется постоянной.
Решение:
I. Добавление CH4 в контейнер увеличивает общее количество молей, но моль He не изменяется, поэтому его парциальное давление остается постоянным. I ложно.
II. Если мы добавим O2 (г) в контейнер, общая масса газов увеличится, а поскольку объем постоянен, плотность газов увеличивается. II это правда.
III. Все газы имеют одинаковую среднюю кинетическую энергию при одинаковой температуре. III это правда.
4. Какие из следующих утверждений верны для CH4 и Он приведен на рисунке ниже; 
I. Давления CH4 и He равны.
II. Количество столкновений с единицей поверхности в единицу времени равно друг другу.
III. Их плотности равны.
Решение:
I. Поскольку CH4 и He имеют одинаковый объем, температуру и моль, их давления также равны. I это правда.
II. Количество столкновений в единицу времени, прямо пропорциональное скорости газов. 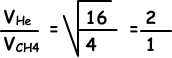
Скорость He больше, чем скорость CH4, поэтому число столкновений He больше, чем число столкновений CH4. II ложно.
III. Поскольку молярные массы CH4 и He различны, их плотности также различны. III ложно.
5. В закрытом контейнере содержится идеальный газ постоянного объема. Какие из приведенных ниже графиков верны для этого газа? (P: давление, T: температура, d: плотность)
Решение:
I. Поскольку число молей и объем газа постоянны, повышение температуры увеличивает давление. I это правда.
II. P.V прямо пропорционально температуре и количеству родинок. Поскольку моль газа постоянна и Т увеличивается; P.V также увеличивается. II это правда.
III. Поскольку число молей, объем и масса газа постоянны; плотность остается постоянной. III это правда.