Электронная конфигурация с примерами
Электронная конфигурация с примерами
Электроны не размещены в фиксированных положениях в атомах, но мы можем предсказать их приблизительное положение. Эти положения называются энергетическими уровнями или оболочками атомов.
- Самый низкий уровень энергии равен 1, и он обозначается целым числом n = 1, 2, 3, 4, 5, 6 … или буквами, начинающимися с K, L, N и Q. Атом может иметь максимум 7 уровней энергии, а электроны могут изменить их уровни в соответствии с их энергиями.
- Каждый энергетический уровень имеет разное количество электронов. Например, мы можем найти число электронов на четырех энергетических уровнях по следующей формуле: 2n2.
1-й энергетический уровень имеет;
2n2=2.12= 2 электрона
2-й энергетический уровень имеет;
2n2=2.22= 8 электронов
3-й энергетический уровень имеет;
2n2=2.32=18 электронов
- Электроны располагаются энергетическими уровнями, начиная с первых энергетических уровней. Если один из уровней энергии заполнен, то электроны размещаются после уровня энергии.
На следующих рисунках показано расположение электронов атомов O и Mg. 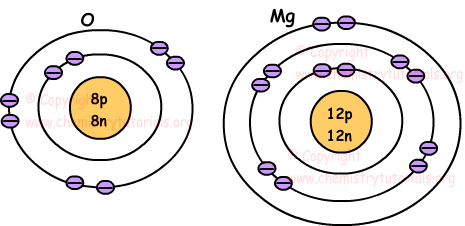
Количество электронов на внешней оболочке атома дает нам следующую классификацию.
Электронная конфигурация атома показывает, оболочки, подоболочки и количество электронов в подоболочках. Мы исследуем электронную конфигурацию на следующих примерах.
Пример: гелий 2 1s2
Где;
1 - главное квантовое число или уровень энергии (оболочка)
s - подуровень или подоболочка (емкость s подоболочки - 2 электрона)
2 показывает количество электронов в s-оболочке
Пример: хлор 17 1s22s22p63s23p5
Коэффициенты 1, 2, 2, 3 и 3 являются уровнями энергии Cl. Как видите, субоболочка «р» может иметь максимум 6 электронов.
Верхние индексы 2, 2, 6, 2 и 5 являются электронами в подоболочках “s” и “p”.
Пример: бром 35
1s22s22p63s23p64s23d104p5
Как видите, субоболочка «d» может иметь максимум 10 электронов.
Пример: тантал 73
1s22s22p63s23p64s23d104p65s24d105p66s24f145d3
Как вы можете видеть, под-оболочка “f” может иметь максимум 14 электронов.