Chemische Bindungen Spickzettel
Chemische Bindungen Spickzettel
Bindungen
Die Kraft, Atome und Moleküle zusammenzuhalten, nennt man Bindung . Wenn eine Bindung Atome zusammenhält, nennen wir sie chemische Bindung . Wenn jedoch Bindungsmoleküle aneinander binden, nennen wir dies molekulare Bindung .
Es gibt zwei Arten chemischer Bindungen.
- Ionenverbindung
- Kovalente Bindung
Darstellungen des Valenzelektronens um Symbol von Elementen mit Punkten. Zum Beispiel; 11Na=1s22s22p63s1
Wie Sie sehen können, hat Na ein Valenzelektron in seiner äußersten Schale. Wir zeigen es mit der Lewis Formel;
Na ●
1. Ionenbindung:
Es ist die Bindung zwischen positiv und negativ geladenen Ionen. Metalle und Nichtmetallatome verbinden sich unter Ionenbindung. Metallatome verlieren Elektronen und werden positiv geladen und Nichtmetallatome nehmen Elektronen auf und werden negativ geladen. Die Kraft, die Ionen zusammenhält, ist eine elektrostatische Anziehungskraft.
2. Kovalente Bindung:
Wenn Atome während des Bindungsprozesses ihre Valenzelektronen teilen, nennen wir das kovalente Bindung. Es findet kein Elektronentransfer statt. Diese Art der Bindung wird zwischen zwei oder mehr Nichtmetallatomen gesehen. Um eine kovalente Bindung zu haben, müssen Atome mindestens ein halb gefülltes Orbital haben. Die kovalente Bindung zwischen H2Molekülen ist nachstehend gezeigt. 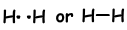
Polarität chemischer Bindungen
In Bindungen, die sich zwischen zwei gleichen Atomen bilden, werden Elektronen von gleichen Kräften angezogen. Wir nennen diese Bindungen unpolare kovalente Bindungen . Wenn zwischen zwei verschiedenen Atomen mit unterschiedlicher Elektronegativität eine kovalente Bindung besteht, ist die Kraft, die die Atome auf ein gemeinsames Elektron ausüben, unterschiedlich. Diese Bindungsarten werden polare kovalente Bindungen genannt.
Hybridisierungs und Bindungsgeometrie
Wir haben gelernt, dass Atome Bindungen bilden können, die der Anzahl der halb gefüllten Orbitale entsprechen. Im Gegenteil, wenn wir die Molekülgeometrie oder die unerwartete Anzahl von Bindungen der Gruppen II A, III A und IV A betrachten, erklären wir dies mit einem anderen Konzept, das als Hybridisierung bezeichnet wird. sp Hybridisierung
sp2 Hybridisierung
sp3 Hybridisierung
- linear
- trigonaler Planar
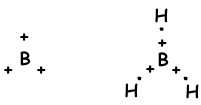
- tetraedrisch
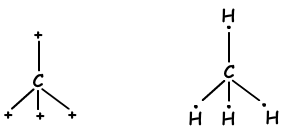
- trigonal pyramidenförmig
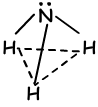
- gebogen
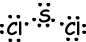
Eine Bindung, die Metallatome zusammenhält, wird als metallische Bindung bezeichnet.
Molekulare Bindungen
Atome, die mit kovalenten Bindungen verbunden sind, produzieren Moleküle und diese Moleküle ziehen sich gegenseitig an und bilden sekundäre Bindungen. Wir untersuchen diese Bindungen unter den drei Titeln Vander Waals-Bindung, Dipol-Dipol-Wechselwirkungen und Wasserstoffbindung.
1) Van-der-Waals-Anleihen:
Wir sehen diese Bindungen in Molekülen mit 100% unpolaren Bindungen wie I2, Cl2, H2 und Molekülen mit polaren Bindungen, aber unpolaren Molekülen wie CO2. Wenn sich unpolare Moleküle wie CO2 annähern, stoßen sie sich gegenseitig ab und die Symmetrie der Moleküle wird gebrochen. Und dann werden positive und negative Dipole im Molekül gebildet. Eine unmittelbare Anziehungskraft dieser Dipole aufeinander sind Van-der-Waals-Bindungen.
2) Dipol-Dipol-Wechselwirkung:
Diese Bindungsarten treten zwischen polaren Molekülen in festen und flüssigen Phasen wie HCl, SO2, H2S, PH3 auf. Da polare Moleküle nicht symmetrisch sind, gibt es Pole mit negativen und positiven Ladungen. Die Anziehung zwischen diesen Polen im Molekül wird als Dipol-Dipol-Wechselwirkung bezeichnet.
3) Wasserstoffbrückenbindungen:
Chemische Bindungen zwischen H und Atomen mit hoher Elektronegativität wie F, N 0 sind stärker als Dipol-Dipol-Wechselwirkungen. Wir können das erklären;
Da O eine hohe Elektronegativität aufweist, zieht es H in der H-O Bindung stark an und diese Bindungen werden als Wasserstoffbindung bezeichnet. Mit anderen Worten wird die Anziehung zwischen dem H-Atom eines Moleküls und dem O-Atom eines anderen Moleküls als Wasserstoffbindung bezeichnet.
Chemische Bindungen im festen Zustand:
1) Ionische Feststoffe:
2) Kovalente Feststoffe:
3) Molekulare Feststoffe:
4) Metallische Feststoffe: