Enlaces químicos
Enlaces
Fuerza de mantenimiento de los átomos y moléculas en conjunto se llama enlace. Los átomos se unen y se vuelve más estable y la energía se libera durante el proceso. Por lo tanto, podemos decir que todas las reacciones de unión son exotérmicas. Por el contrario, todas las reacciones ruptura de enlaces son endotérmicas. Los electrones de valencia de los átomos y las moléculas desempeñan un papel en la unión. Si vínculo une a los átomos juntos, entonces lo llamamos enlace químico. Sin embargo, si un enlace une moléculas, lo llamamos enlace molecular.
Enlaces químicos:
Hay dos tipos de enlaces químicos;
enlace iónico
enlace covalente
Mientras elementos forman compuestos tienden a tener configuración electrónica de los gases nobles. A excepción de Él, todos los gases nobles poner fin a su configuración electrónica con ns2 NP6. En otras palabras, todos los depósitos de los gases nobles están llenos. Son demasiado estable. Los átomos también quieren ser estable y completar su número de electrones de valencia a 8.
Estructuras de Lewis de los átomos
Las representaciones de los electrones de valencia alrededor símbolo de los elementos con puntos. Por ejemplo;
11Na=1s22s22p63s1
Como se puede ver Na tiene un electrón de valencia en su capa externa. Nos muestran con Lewis fórmula;
Na ●
Por otro lado, si 1s, 2s y 2p están llenos, entonces ellos no están representados con Lewis fórmula.
Ejemplo: 17Clescritura Lewis fórmula de Cl átomo.
17Cl=1s22s22p63s23p5
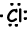
Los electrones de valencia de los iones también se puede representar con la fórmula de Lewis. Por ejemplo;
Lewis fórmula de 9F-1 es;
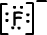
1. Enlace iónico:
Es el vínculo entre los iones cargados positiva y negativamente. Los metales y los átomos no metálicos se unen con enlace iónico. Metal átomo pierde electrones y se carga positivamente y un átomo de no metal aceptar electrones y se carga negativamente. Fuerza de mantenimiento de los iones juntos es la fuerza de atracción electrostática.
En la tabla periódica de los metales del grupo A perder electrones igual a su número de grupo. Por ejemplo, metales en IA pierde un electrón y se convierte en un ión, metales en II perder 2 electrones y se convierte en dos iones, metales en III A perder 3 electrones y se convierte en tres de iones.
No metales aceptan electrones que completa sus electrones de valencia de los gases nobles. Por ejemplo, los no metales en el grupo VA aceptan 3 electrones y se convierte en iones de -3, no metales en VI Un grupo acepta 2 electrones y se convierte en iones de -2, no metales en VII Un grupo acepta un electrón y se convierte en iones -1.
Durante el proceso de unión iónica, el número de electrones aceptados es igual al número de electrones perdidos.
Ejemplo: Analizar vínculo entre la molécula de NaCl.
11Na pierde un electrón y se convierte en Na +. 17Cl acepta un electrón y se convierte en Cl-. La atracción entre los iones opuestos formar enlace iónico.
- Fuerza de enlace iónico está directamente relacionada con tendencia a perder electrones de los metales y no metales de aceptor de electrones.
2. Enlace covalente:
Si los átomos comparten sus electrones de valencia durante el proceso de unión, lo llamamos enlace covalente. No hay transferencia de electrones. Este tipo de enlace se ve en entre dos o más átomos no metálicos. Para tener un enlace covalente, los átomos debe tener al menos un medio lleno orbital. Enlace covalente entre la molécula de H2 se indica a continuación;
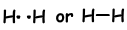
Número de enlace covalente es igual a la mitad el número de orbitales llenos.
Primera unión covalente entre dos átomos se denomina enlace sigma y mostró con “σ”.
Sólo hay un enlace sigma entre dos átomos y enlaces otros son llamados enlaces pi y mostró con “π”.
Ejemplo: Analizar vínculo entre la molécula de O2.
8O=1s22s22p4
O mostrando a la órbita y del esquema de puntos de Lewis;

Como se puede ver en el esquema orbitales y de puntos de Lewis la fórmula O tiene dos orbitales medio llenos y puede hace dos bonos. Primer bono se llama sigma y mostró a continuación;
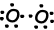
Estos átomos de O comparten sus electrones y se convierte en la segunda molécula de O2;
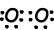
Ejemplo: mostrar los enlaces covalentes de NH3.
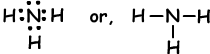
Ejemplo: ¿Cuál de las siguientes afirmaciones es falsa para el elemento de 8O.
I. Se trata de no metal
II. Se puede hace dos enlaces
III . En el estado de configuración del terreno de electrones que tiene dos orbital lleno
IV. Me hace enlace covalente con el elemento 9F.
V. Lo hace con la 11Na enlace iónico y el compuesto de formas; Na2O
Solución:
8O tiene configuración electrónica en estado fundamental;

I. Dado que el número de electrones de valencia de los 8O es de 6, es no metal. verdadero
II. Tiene dos medio lleno orbital, por lo que puede hace dos enlaces. verdadero
III. Como se puede ver en el esquema orbitales, 8O tiene 3 llena orbital en el estado fundamental. falso
IV . 9F tiene configuración electrónica en estado fundamental;
F: 1s22s22p5
F tiene 7 electrones de valencia por lo que es no metal. Hemos aprendido que dos átomos no metálicos unirse con enlace covalente. verdadero
V. 11Na tiene configuración electrónica en estado fundamental;
Na: 1s22s22p63s1
Na da un electrón y se convierte en Na+ y O acepta 2 electrones y se convierte en S-2. Por lo tanto, vínculo entre ellos es enlace iónico. Es cierto.