Estructura atómica Exámen 3 y soluciones de problemas
Estructura atómica Exámen 3 y soluciones de problemas
1. ¿Hay 6C átomo de simetría esférica?
Solución:
Electron configuración de C;
C: 1s22s22p2
Puesto que no hay simetría esférica p orbital incluye dos electrones en este elemento. Debe tener elementos esféricos de simetría que tienen orbitales llenos o medio llenos.
2. El fósforo blanco y el fósforo rojo son elementos alotrópicas del fósforo. ¿Cuáles de las siguientes declaraciones son verdaderas para ellos;
I. Diferentes estructuras de electrones de los átomos de ellos son
II. Ellos tienen diferentes densidades
III. Propiedades químicas del compuesto formado por P2O5 Estos son alotrópica diferente.
Solución:
I. Alótropo incluyen átomos pertenecen a un mismo elemento. ASÍ mucho, las estructuras electrónicas de los átomos debe ser el mismo. Que es falso
II. Desde alotrópica tienen propiedades físicas diferentes, no debe estar vacío de ellos tienen diferentes densidades. II es verdadera.
III. Propiedades químicas del alotrópica con otros elementos son los mismos. III es falsa.
3. ¿Cuáles de las siguientes, las parejas tienen mismas propiedades químicas?(11H, 12D)
I. 2656Fe+2 y 2656Fe+3
II. 2656Fe y 2756Co
III. H2O y D2O
Solución:
Tener mismas propiedades químicas, los asuntos deben tener el mismo número de protones y electrones.
I. Debido a que tienen el mismo número de protones pero distinto número de electrones, sus propiedades químicas son diferentes.
II. Ambos son un número diferente de protones y neutrones. Por lo tanto, las propiedades químicas de los mismos son también diferentes.
III. Tienen el mismo número de protones y electrones. Tienen mismas propiedades químicas.
4. ¿Cuáles son las declaraciones falsas de los siguientes, para X e Y átomos;
X: 1s22s22p63s1
Y: 1s22s22p63s23p64s1
I. Estado excitado de X es Y
II. X e Y son átomos del mismo elemento
III. Y es más estable que X
Solución:
I. De acuerdo con el estado fundamental configuración de electrones de los átomos de X está escrito. Pero, en Y está escrito para un electrón 4s orbital 3s. ASÍ mucho, estado excitado de X. Y es Si la energía se le da a X, se puede convertir en Y. I es verdadera.
II. Ya que pertenecen a un mismo elemento que ambos tienen 11 electrones. II es verdadera.
III. Puesto que X es menor que la energía de la energía de la Y, que es más estable que Y. III es falsa.
5. Si el número de orbitales llenos de X es 7 y media-orbitales es de 2, ¿cuáles de las siguientes se pueden encontrar?
I. número atómico
II. El número de electrones de valencia
III. Misa número de
Solución:
Nos llena y dos a medio llenar orbitales dibujar como 7;
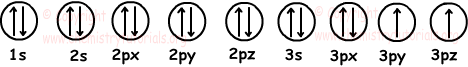
Configuración electrónica:
1s22s22p63s23p4
Número de electrones: 2 +2 +6 +2 +4 = 16
En los átomos neutros, el número de electrones es igual al número de protones y el número atómico. Así que, usando los datos dados podemos encontrar elementos de número atómico. También encontramos electrones de valencia de los elementos mediante la adición de ellos la vida.
3s y 3p orbitales de valencia son.
El número de electrones de valencia = 2 +4 = 6
Tenemos que saber encontrar el número de número de masa neutrones. No podemos encontrar los datos del número de masa dada.
6. ¿Cuál de las siguientes declaraciones son verdaderas para 17X, 20Y y los elementos 18Z?
I. YX2compuesto Y y X forma los elementos
II. Y y Z+1 son un ion isoelectrónico
III. Configuración electrónica de los 4s2 orbital con una Z+1 pasado.
Solución:
17X configuración única de electrones: 1s22s22p63s23p5
20Y configuración única de electrones: 1s22s22p63s23p64s2
Acepta un electrón X e Y da dos electrones tienen una configuración electrónica de gas noble. X es Y es no metal y el metal, que están siguiendo, forma compuesta;
Que es cierto YX2
Dado que la configuración electrónica del ni son isoelectrónico Y y Z+1 son una diferente. II es falso.
Z+1 configuración única de electrones: 1s22s22p63s23p5
III es falsa