Gases cheat Sheet
Gases Cheat Sheet
Gases
El gas es una de las fases de la materia. Las distancias entre los átomos o moléculas en fase gaseosa son más grandes que los sólidos y líquidos.
Volumen (V)
Volumen de gas es igual al volumen del recipiente. No tienen volúmenes específicos. Bajo gas mole estándar de temperatura y presión 1 tiene 22,4 litros de volumen. Unidades de volumen que usamos aquí es litros.
Temperatura (T)
En los cálculos de los gases de temperatura absoluta (K) se utiliza. En -273, difusión de los gases es igual a cero y en la naturaleza Kelvin es la unidad de la temperatura y la relación entre K y 0 º C es;
presión:
La presión es la fuerza que actúa perpendicularmente sobre la superficie de la unidad. Unidad de presión es mm Hg, Hg o cm atm. En general, (presión atmosférica) se utiliza atm.

Vamos a P0 es la presión atmosférica;
P0=h cm Hg
P0 = 76 cm Hg a nivel del mar.
h depende;
densidad del líquido en un recipiente poner
h no depende de la zona de sección transversal del tubo.
manómetros
La presión de gas en un recipiente cerrado es igual en todas partes. Manómetros se utilizan para medir la presión del gas en container.There cerrado dos tipos de manómetros, manómetros final cerrado y abierto manómetros final
Teoría cinética de los gases
Teoría cinética es un modelo que se ocupa de movimiento de los átomos de gas / moléculas en un recipiente cerrado.
Las moléculas de gas o los átomos de hacer movimientos aleatorios en un recipiente.
Durante este movimiento al azar, chocan entre sí y de la superficie del envase.
Que se difunden de forma homogénea en el recipiente. Si ponemos dos gases diferentes en un mismo recipiente, se produce una mezcla homogénea.
Los espacios entre las moléculas y los átomos en los gases son más grandes que los espacios entre partículas de sólidos y líquidos.
En un instante de tiempo las velocidades de los átomos de gas / moléculas no son iguales. Ellos son inversamente proporcionales a la raíz cuadrada de la masa molecular y directamente proporcional a la raíz cuadrada de la temperatura absoluta.
A la misma temperatura, el promedio de las energías cinéticas de todos los átomos / moléculas son iguales.
Las colisiones de los átomos de gas / moléculas entre sí y de la superficie del recipiente son elásticos, por lo tanto no se pierde energía.
La atracción entre los átomos de gas / moléculas son débiles.
Efusión y difusión de los gases
difusión:
Las moléculas de la mezcla de un gas con moléculas de otro gas se llama difusión. El olor de un perfume o una comida en una habitación son algunos ejemplos comunes de difusión de los gases. Los gases tienen diferentes tasas de difusión a diferentes temperaturas. Fórmula siguiente muestra relación de las tasas de difusión de dos gases a la misma temperatura.
Tasa de difusión (r) es directamente proporcional a la velocidad molecular media.
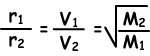
Donde, r1 y r2 son las tasas de difusión de gas1 y de gas2, V1 y V2 son velocidades promedio molecular de los gases y M1 y M2 son las masas moleculares de los gases.
Efusión:

Como se puede ver en la imagen dada anteriormente, el movimiento de los gases de un recipiente a otro pasando a través de pequeño orificio se conoce como derrame (como aparece en la imagen, en el segundo contenedor general, está vacío, o vacío). Difusión se lleva a cabo bajo constante la presión sobre el derrame sucede lo contrario en la diferencia de presión entre los contenedores.
1. Ley de Boyle: (relación presión-volumen)
Podemos definir la ley de Boyle ;
“Bajo una temperatura constante y el número de partículas, la presión y el volumen de los gases son inversamente proporcionales entre sí.”
V es inversamente proporcional a P o
P.V=constante
Por otra parte;
P1.V1=P2.V2=P3.V3=.. (para el mismo gas a temperatura constante y el número de partículas.)
2. Ley de Charles: (Volumen de temperatura respecto)
Con el número constante de partículas y presión, el volumen de gas es directamente proporcional a la temperatura absoluta. Esta declaración se llama “Ley de Charles “.
V / T = constante (número de partículas “n” y la presión constante “P”)
3. / Gay Lussac Amonton la Ley: (relación presión-temperatura)
Cuando aumentamos la temperatura del gas, colocado en un recipiente con volumen constante, la velocidad del gas aumentan las moléculas. El aumento en la velocidad de la colisión de las moléculas de aumentar el número de superficies de esto es la presión. En otras palabras, el aumento de la temperatura del gas a volumen constante y el número de partículas, aumentar la presión del gas.
Así; P1/T1=P2/T2
4. Ley de Avogadro: (Volumen-Número de la relación de las partículas)
Gases, con la misma presión y temperatura, tienen el mismo número de partículas en la misma cantidad de volúmenes. En otras palabras, el volumen y número de partículas de los gases son directamente proporcionales entre sí. Nos dijo que en los temas anteriores de que el gas es 22,4 litros 1mol bajo estándar de presión y temperatura y el gas 1mol contiene 6,02 x1023 moléculas / átomos.
V/n=constante o;
P1/n1=P2/n2
n de gas ideal, las moléculas no tienen volumen y no hay interacción entre ellos. En términos reales, no hay un gas, es sólo una suposición. Todos los gases reales se ha de pequeños volúmenes y hay interacciones entre ellos.
P.V=n.R.T
Donde, P presión, volumen V, n el número de partículas, R constante de los gases 0,08206 L atm / mol K o 22,4 / 273 L atm / mol K, y T la temperatura
Densidad de los gases es muy pequeña con respecto a las fases sólida y gaseosa. Podemos encontrar la densidad con la siguiente fórmula;
d(gas)=m(gas)/V(gas)
si lo sustituimos en la ley del gas ideal;
P.V = n.R.T donde n = masa / masa molar
P.V=(m/Mm).R.T
P.Mm=(m/V).R.T
P.Mm=d.R.T
d=(P.Mm)/(R.T)
Mezclas y la presión parcial de gases
Si los gases no reaccionan entre sí, producen una mezcla homogénea.
Presión parcial:
Presión parcial de uno de los gases en la mezcla colocada en un recipiente cerrado es igual a la presión del mismo gas en el recipiente mismo a la misma temperatura.

Ley de Dalton de presión parcial:
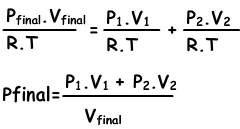
“La suma de las presiones parciales de los gases en el contenedor nos da la presión total de la mezcla.” Esta declaración se llama la ley de Dalton de las presiones parciales. Cuadro que se presenta por encima de otros ejemplos de esta ley.
Ptotal=PH2+PCO2
Mezclas de gases ca se encuentra con la siguiente ecuación;