Gassen Examen 4 En Probleem Oplossingen
Gassen Examen 4 En Probleem Oplossingen
1. Vind dichtheid van C4H8 onder 273 0C temperatuur en 2 atm druk. (H = 1, C = 12)
Oplossing: T=273 + 273 = 546 0K
P = 2atm en molecuulgewicht van C4H8 = 4. (12) + 8 (1) = 56 g / mol
We gebruiken de ideale gaswet om de dichtheid van gas te vinden;
P.MC4H8=d.R.T
2.56=d.0,082.546
d=2,5g/L
2. Als de som van drukken van 1,6 g He en 0,8 g CH4 gassen 0,9atm is, zoek dan de gedeeltelijke drukken van He en CH4 (He = 4, C = 12, H = 1)
Oplossing:
Mol gassen; nHe=1,6/4=0,4mol
nCH4=0,8/16=0,05mol
ntotal=0,4 + 0,05=0,45mol
Gedeeltelijke drukken van gassen worden gevonden door formule;
Px=(nx/ntotal).Ptotal
PHe=0,4/0,45,0,0=0,8atm
PCH4=0,05/0,45.0,4=0,1atm
3. Er is He gas in gegeven container. Welke van de volgende beweringen is waar voor deze container bij constante temperatuur?

I. Als we CH4 gas toevoegen aan de container, neemt de partiële druk van Hij toe.
II. Als we O2 (g) toevoegen aan de container, neemt de dichtheid van de gassen in de container toe.
III. Als we Ar gas in een container toevoegen, blijft de gemiddelde kinetische energie constant.
Oplossing:
I. Het toevoegen van CH4 aan de container verhoogt het totale aantal mol maar de mol van Hij verandert niet, zodat de partiële druk constant blijft. I is fout.
II. Als we O2 (g) toevoegen aan de container, neemt de totale massa van gassen toe en aangezien het volume constant is, neemt de dichtheid van gassen toe. II is waar.
III. Alle gassen hebben dezelfde gemiddelde kinetische energie onder dezelfde temperatuur. III is waar.
4. Welke van de volgende uitspraken zijn waar voor CH4 en Hij gegeven in onderstaande afbeelding; 
I. Drukken van CH4 en Hij zijn gelijk.
II. Aantal botsingen met oppervlakte-eenheid in tijdseenheid zijn gelijk aan elkaar.
III. Hun dichtheden zijn gelijk.
Oplossing:
I. Aangezien CH4 en Hij een gelijk volume, temperatuur en mol hebben, is hun druk ook gelijk. I is waar.
II. Aantal botsingen in tijdseenheid is recht evenredig met de snelheid van gassen. 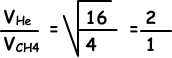
Snelheid van Hij is groter dan snelheid van CH4, dus aantal botsingen van Hij is groter dan aantal botsingen van CH4. II is onjuist.
III. Omdat de molaire massa van CH4 en Hij verschillend zijn, zijn hun dichtheden ook verschillend. III is onjuist.
5. Er is wat ideaal gas in een gesloten container met constant volume. Welke van de onderstaande grafieken zijn waar voor dit gas? (P: druk, T: temperatuur, d: dichtheid)
Oplossing:
I. Aangezien het aantal mol en het volume gas constant zijn, verhoogt de stijgende temperatuur de druk. I is waar.
II. P.V is recht evenredig met temperatuur en aantal mol. Omdat mol gas constant is en T toeneemt; P.V neemt ook toe. II is waar.
III. Aangezien het aantal mol, volume en massa gas constant zijn; dichtheid blijft constant. III is waar.