Chemisch Evenwicht Cheat Sheet
Chemisch Evenwicht Cheat Sheet Chemisch Evenwicht
Tot nu toe hebben we geleerd dat reacties in één richting plaatsvinden. Maar nu behandelen we omkeerbare reacties. Reactie, hieronder gegeven, bevindt zich in een gesloten container;
A(g) + B(g) → C(g) + D(g)
In het begin reageert A met B en produceert C en D gas. Dit is een voorwaartse reactie en de snelheid van deze reactie wordt geschreven als;
Reactiesnelheid= kf.[A].[B]
Omdat concentraties van A en B met de tijd afnemen, neemt ook de voorwaartse reactiesnelheid af. Bovendien botsen geproduceerde C en D moleculen op elkaar en vormen A en B moleculen. Dit wordt omgekeerde reactie genoemd en de snelheid ervan wordt geschreven als;
Reactiesnelheid= kr.[C].[D]
Evenwichts constante van de volgende reactie wordt geschreven als;
aA + bB → cC + dD
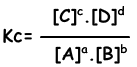
Homogeen En Heterogene Evenwicht
Als zaken in evenwichtsreactie zich allemaal in één fase bevinden, is het homogeen evenwicht, als ten minste één van de materie een andere fase heeft, is het een heterogeen evenwicht. Wanneer we een evenwichtsvergelijking van heterogeen evenwicht schrijven, schrijven we geen zuivere vaste en zuivere vloeibare materie in een evenwichtsvergelijking.
CaCO3(s) → CaO(s) + CO2(g)
Deze reactie is een heterogene evenwichtsreactie en we schrijven geen CaCO3 (s) en CaO (s) in evenwichtsvergelijking.
Evenwichts Constante In Termen Van Partiële Druk
Concentraties van gassen zijn recht evenredig met de partiële druk ervan. We kunnen dus evenwichtsconstante schrijven in termen van partiële drukken.
N2(g) + 3H2(g)→ 2NH3(g)
Evenwichts constante van deze reactie in termen van concentraties is;
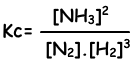
Evenwichts constante van deze reactie in termen van partiële druk is;
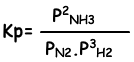
Factoren Die Van Invloed Zijn Op Het Chemisch Evenwicht
1. Invloed van concentratie op evenwicht:
Zaken toevoegen of verwijderen in reactie-effectevenwicht. Het toevoegen van reactanten of het verwijderen van producten verhoogt bijvoorbeeld de opbrengst van het product. Integendeel, het toevoegen van producten of het verwijderen van reactanten verhoogt de opbrengst aan reactanten. Met andere woorden, in de eerste situatie verschuift het evenwicht naar rechts en in de tweede situatie verschuift het evenwicht naar links.
2. Invloed van temperatuur op evenwicht:
- In een endotherme reactie; toenemende temperatuurverschuiving evenwicht naar rechts en evenwichtsconstante neemt toe.
- In een endotherme reactie; toenemende temperatuurverschuiving evenwicht naar links en evenwichtsconstante neemt af.
3. Invloed van druk op het evenwicht:
- Als een van de zaken in de container onder constante temperatuur en druk wordt verwijderd of toegevoegd, verandert de druk van het systeem. Er wordt echter rekening gehouden met verandering in de concentratie en niet met de druk.
- De temperatuur kan worden gewijzigd onder constant volume. In deze situatie houden we, zelfs als de druk verandert, rekening met veranderingen in de temperatuur terwijl we het evenwicht constant vinden.
- Als bij gasreacties het aantal mol niet verandert, heeft de druk geen invloed op het evenwicht.