Плотность газов с примерами
Плотность газов с примерами
Плотность газов слишком мала по сравнению с твердой и газовой фазами. Мы можем найти плотность по следующей формуле;
d(газ) = m (газ) / V (газ)
если мы подставим его в закон идеального газа;
P.V = n.R.T где n = масса / молярная масса P.V=(m/Mm).R.T
P.Mm=(m/V).R.T
P.Mm=d.R.T
d=(P.Mm)/(R.T)
Как видно из формулы; плотность газов прямо пропорциональна давлению и молярной массе и обратно пропорциональна температуре.
Пример: Найти плотность C4H8 при 273 ° C и давлении ниже 2 атм. (H = 1, C = 12)
Решение: сначала мы создаем единичные соглашения; T=273+273=546 K
P=2 атм
C4H8=4.12+8.1=56 г / моль
Используя формулу, приведенную выше;
P.Mm=d.R.T
2.56=d.(22,4/273).546
d=2,5 г / л
Пример: если мы добавим немного CH4 в контейнер, указанный ниже, при постоянной температуре; Какие из следующих утверждений верны в отношении газов в этом контейнере? (He = 4, С = 12, Н = 1)

I. Увеличивается плотность смеси
II. Объем увеличивается
III. Давление увеличивается
Решение:
Молярная масса CH4 = 12 + 4,1 = 16
Поскольку поршень контейнера является динамическим, когда мы добавляем CH4, объем смеси увеличивается. Молярная масса CH4 больше, чем He, поэтому плотность смеси также увеличивается.
P.Mm = d.R.T
Увеличивается объем газового баланса и давление остается постоянным.
Пример: Какие из графиков верны для идеального газа. 
Решение:
I. Использование закона идеального газа;
P.V = n.R.T
Р = n.R.T / V,
Поскольку R, n и V постоянны, P прямо пропорционально температуре. График I верно.
II. Молярный объем V / н. Использование закона идеального газа;
В / п = комнатная температура / Р
Поскольку R, P и T постоянны, V / n должно быть постоянным. Таким образом, второй график неверен, линия, показывающая соотношение между V и n, должна быть параллельна n.
III. Мы пишем закон идеального газа для плотности; d=P.Mm/R.T
Mm, R и P постоянны, поэтому d обратно пропорционально T. III. график верный.
Пример: приведенный ниже график показывает зависимость плотности от объема для X (газа) при температуре 0 ° C. Если давление X (газа) в точке A равно 1 атм, то из следующего утверждения верны для этого газа. 
I. n = 1 моль
II. Давление в точке B составляет 0,5 атм.
III. Молярная масса газа составляет 56 г
Решение:
I. Закон идеального газа в точке А; PA.VA=n.R.T
Т = 0 ° С или 273 К
V = 11,2 литра
P = 1 атм
п = PA.VA / = комнатная температура (1.11,2) / (22,4 / 273) 0,273) = 0,5mol
I. ложно
II. n и T постоянны, поэтому мы можем написать;
PA.VA=PB.VB
(1.11,2)=PB.22,4
PB = 0,5 атм, II верно
III. плотность в точке А есть;
dA=PA.Mm/R.T
Мм = (dA.R.T) / PA = (2,5. (22,4 / 273) 0,273) / 1
Мм = 56 г / моль
1 моль газа содержит 56 г, так что III верно.
Пример: Какие из следующих утверждений верны для газов He и O2 при одинаковой температуре. (He = 4, О = 16) 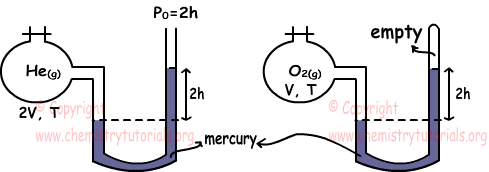
I. nHe=4nO2
II. dHe=8dO2
III. Средние кинетические энергии He и O2 равны.
Решение:
Мы находим давление газов с помощью манометров. PHe=2h+2h=4h
PO2=2h
Чтобы найти связь между числом молей газов, мы используем закон идеального газа.
PHe.VHe=nHe.R.THe
nHe=4h.2V/R.T
PO2.VO2=nO2.R.TO2
nO2=2h.V/R.T
Соотношение nHe и nO2
nHe/nO2=4/1 Таким образом, I верно.
Мы снова находим плотность газов, используя закон идеального газа.
Молярная масса He = 4 и Молярная масса
O2 = 2.16 = 32 dHe=PHe.MHe/R.T
dHe=4h.4/R.T
dO2=PO2.MO2/R.T
dO2=2h.32/R.T
Коэффициент де лас денсидэйдс;
dHe/d/O2=1/4 т. II. ложно
III. Поскольку температура газов одинакова, их средняя кинетическая энергия также одинакова. III. правда.