Смеси и парциальное давление газов с примером
Смеси и парциальное давление газов с примером
Если газы не реагируют друг с другом, они образуют гомогенную смесь. Каждый газ в контейнере прикладывают давление. Теперь мы изучаем понятие, связанное с этой темой; частичное давление.
Частичное давление:
Парциальное давление одного из газов в смеси, помещенной в закрытый контейнер, равно давлению того же газа только в одном контейнере при той же температуре. Следующая картинка обобщает то, что мы пытаемся сказать. 
Если температура и объем газа поддерживаются постоянными, парциальное давление газа прямо пропорционально количеству частиц газа.
Закон частичного давления Далтона:
«Сумма парциальных давлений газов в контейнере дает нам общее давление смеси». Это утверждение называется законом парциального давления Далтона. На рисунке выше приведены также примеры этого закона.
Pполная =PH2+PCO2
Газы в одном и том же контейнере имеют равные объемы, и они имеют общее давление в соответствии с их количеством молей.
Если мы напишем закон идеального газа для общего газа в смеси и одного из газов и разделим их друг на друга, мы получим уравнение парциального давления одного газа в смеси.
P1.V = n1.R.T
¯¯¯¯ ¯¯¯¯¯¯
Pполная.V=nполная.R.T
P1=(n1/n полная).P полная
(n1/nполная) называется мольной долей газа 1
P2=(n2/n полная).P полная
P3=(n3/n полная).P полная
. . . . . . . . . . . . . . . .
Пример: в закрытом контейнере 4 грамма H2. Если мы добавим 4 г He к этому контейнеру, какие из следующих утверждений станут правдой? (H = 1, He = 4)
I. Давление H2 равно начальному давлению этого.
II. Кинетические энергии частиц H2 и He в смеси равны.
III. Парциальное давление H2 в смеси вдвое больше He.
Решение:
I. Находим парциальное давление H2, используя закон идеального газа.
PH2.V=nH2.R.T
PH2=nH2.R.T/V
Поскольку V, T и nH2 постоянны, парциальное давление H2 не изменяется. I. правда.
II. Поскольку температура однородной смеси в контейнере одинакова, кинетическая энергия частиц не изменяется, и кинетическая энергия частиц H2 равна кинетической энергии частиц He. II. правда.
III. Молярная масса H2 = 2,1 = 2
Моль H2;
nH2=4/2= 2 моль
Крот он;
nHe=4/4 = 1 моль
Парциальное давление прямо пропорционально числу молей; Таким образом, парциальное давление H2 вдвое превышает парциальное давление Не. III. правда.
Пример: Контейнер содержит 0,4 моль CH4, 0,1 моль и 0,3 моль He. Если парциальное давление He составляет 60 см рт.ст., какое из следующих утверждений неверно? (C = 12, H = 1, S = 32, O = 16)
I. Смесь содержит 50% CH4 на моль
II. Общее давление контейнера 160 см рт.
III. Плотность SO2 в четыре раза превышает плотность CH4
Внутривенно Парциальное давление SO2 составляет 20 см рт.
Решение:
I. общее количество молей газов;
nполная= = 0,4 + 0,1 + 0,3 = 0,8 моль nCH4=(0,4/0,8).100=50
I ложно
II. Парциальное давление Не 60 см рт.
PHe=(nHe/nполная).Pполная
60=(0,3/0,8).Pполная
Pполная=160 см рт
II ложно
III. Молярные массы SO2 = 32 + 2,16 = 64 и CH4 = 12 + 4,1 = 16
массы mSO2=nSO2.MmSO2=0,1.64=6,4 г и mCH4=nCH4.MmCH4=0,4.16=6,4 г
Так как они имеют равные объемы и массы, d = m / V
их плотности также равны, III. ложно
IV. Парциальное давление SO2 PSO2=(nSO2/ntotal).Ptotal
PSO2=(0,1/0,8).160
PSO2=20 см рт IV. правда
Давление газов в сборных контейнерах
На рисунке ниже показаны два контейнера в сочетании с краном А. 
Газы X и Y помещаются в контейнеры I и II, они не вступают в реакцию друг с другом. Если мы откроем кран между контейнерами, какое количество всей системы изменится? Мы пытаемся ответить на этот вопрос сейчас.
Мы узнали, что газы распространяются от высокого давления до низкого давления. В этой системе газ, имеющий более высокое давление, диффундирует в другой контейнер до баланса давления. Поскольку никакой реакции не происходит, начальное и конечное число молей газов X и Y равны. Общее количество родинок равно сумме n1 и n2
Уравнение I. n полная = n1+n2
Если мы напишем закон идеального газа для каждой ситуации;
n1=(P1.V1)/(R.T), n2=(P2.V2/R.T), полная=(Pконечное.Vконечное/.RT)
подставим эти уравнения в уравнение I. и получим;
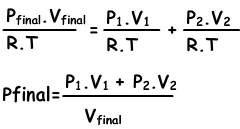
Мы можем написать V1+V2 в Vконечное также.
Пример: если мы откроем кран и установим системный баланс, какие из следующих утверждений станут верными для этой системы? 
I. Конечное давление Y больше, чем начальное давление Y
II. Парциальные давления X и Y становятся равными.
III. Общее давление становится 2,4 атм.
Решение:
I. Начальный объем газа Y равен 6 В, конечный объем Y равен 10 В. Поскольку температура равна числу молей, но объем Y увеличивается, его давление уменьшается. I. ложно
II. Парциальные давления газов прямо пропорциональны их количеству молей. Мы находим число молей газов, а затем даем соотношение между их парциальными давлениями, используя закон идеального газа.
n=P.V/R.T
nX=Px.Vx/R.T=3.4V/RT=12V/RT
nY=PY.VY/R.T=2.6V/RT=12V/RT
Поскольку число молей газов одинаково, их парциальные давления также становятся равными.
III.
Pконечное=(Px.Vx+Py.Vy)/(Vx+Vy)
Pконечное=(3.4V+2.6V)/(4V+6V)
Pконечное=24V/10V=2,4 атм
III. тоже верно