Решения рабочий лист
Решения рабочий лист
«Растворы» представляют собой гомогенные смеси двух или более чем двух веществ. Растворы могут находиться в твердой, жидкой и газовой фазах. «Растворитель » - это среда, в которой растворяется вещество, а «растворенный » - это вещество, которое растворяется в растворителе. Например, в водном растворе сахара вода - это растворитель, который растворяет сахар, а сахар - это растворенное вещество, которое растворяется в воде.
Разбавленный раствор. Растворы, содержащие небольшое количество растворенного вещества в растворителе, называются разбавленными растворами.
Концентрированный раствор: растворы, в которых большое количество растворенного вещества растворяется в растворителе.
Сольватация: это процесс растворения растворенного вещества в растворителе.
1) ионная сольватация: если растворитель распадается на ионы, мы называем эти растворы ионными растворами. Кислоты, основания и соли образуют ионные растворы.
2) Молекулярная сольватация: если вещество разлагается на молекулы, мы называем эти растворы молекулярными растворами. Растворение сахара в воде является примером молекулярной сольватации.
Мы можем исследовать решения под двумя заголовками в соответствии с их коэффициентом насыщения; такие как насыщенные растворы и ненасыщенные растворы и перенасыщенные растворы.
1) Насыщенные растворы: если раствор растворяет максимальное количество растворенного вещества при определенной температуре, то мы называем их насыщенными растворами. В растворах этого типа на дне резервуара могут быть твердые вещества (нерастворенные).
2) Ненасыщенные растворы: если растворы могут растворять больше растворенных веществ при определенной температуре, то мы называем их ненасыщенными растворами. Если вы испарили часть растворителя или добавили немного растворенного вещества, вы можете сделать их насыщенными растворами.
3) Пересыщенные растворы. Если растворы содержат больше растворенного вещества, чем его емкость, мы называем эти растворы перенасыщенными растворами. Мы готовим их нагреванием раствора и добавлением растворенного вещества, после чего медленно остываем пересыщенный раствор. Вы можете наблюдать кристаллизацию растворенного вещества в пересыщенных растворах.
Растворимость и факторы, влияющие на растворимость
Растворимость - это количество растворенного вещества в 100 см3 (100 мл) растворителя.
Факторы, влияющие на растворимость
Растворитель и типы растворенного вещества, температура, давление и общий ионный эффект являются факторами, влияющими на растворимость.
Факторы, влияющие на скорость сольватации
- Типы материи
- Изменение температуры (снижение для экзотермических растворов и увеличение для эндотермических растворов)
- Поверхность контакта (сахарный песок растворяется быстрее, чем кусковой сахар)
- Смешивание раствора увеличивает скорость сольватации.
Концентрация - это количество растворенного вещества в данном растворе. Мы можем выражать концентрацию по-разному, например, в процентах или в молях.
1) Концентрация в процентах:
Именно количество растворенного вещества растворяется в 100 г растворителя. Если концентрация раствора составляет 20%, мы понимаем, что в 100 г раствора содержится 20 г растворенного вещества.
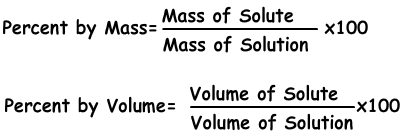
2) Концентрация по кроту:
Мы можем выразить концентрацию растворов по молям. Количество молей на литр называется «молярность », показанная с помощью M. 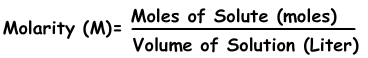
3) моляльность:
Моляльность - это еще одно выражение концентрации растворов. Обозначается буквой «m», а формула моляльности:
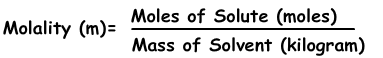
4) Нормальность:
Мы можем выразить концентрацию по-другому с нормальностью, используя эквиваленты растворенных веществ. 
Разведение и плотность растворов
Разбавление - это процесс добавления растворителя в раствор. Поскольку количество растворенного вещества остается постоянным, концентрация раствора уменьшается. Находим связь между концентрацией растворов до и после разбавления по следующей формуле:
M1.V1=M2.V2
Где M1 - начальная молярность, а M2 - конечная молярность, а V1 и V2 - начальный и конечный объемы раствора.
Чтобы увеличить концентрацию растворов, следует добавить растворенный или выпарить растворитель из раствора. Формула, приведенная выше, также используется для увеличения концентрации растворов;
M1.V1=M2.V2
Плотность решений
Находим плотность решений по следующей формуле; 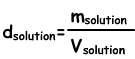
Концентрация ионов с примерами
- Температура кипения, температура замерзания, давление пара и такие свойства, как плотность растворов, отличаются от свойств чистого растворителя. Например, вода кипит при 100 ° С, наоборот, раствор в соленой воде кипит выше 100 ° С.
- Если растворенные в воде вещества не являются летучими, они предотвращают испарение воды, в результате чего температура кипения воды увеличивается, а температура замерзания воды уменьшается. Зимой соль разливают по дороге, чтобы уменьшить температуру замерзания воды.
- В растворе повышение температуры кипения прямо пропорционально молярной концентрации частиц в растворе.
- В жидких растворах уменьшение точек замерзания и давления пара обратно пропорционально молярной концентрации частиц в растворе.
- Проводимость электричества прямо пропорциональна молярной концентрации ионов в растворах. Например, алкоголь и сахар не проводят электричество.