Скорости реакций (химическая кинетика) рабочий лист
Скорости реакций (химическая кинетика) рабочий лист
Скорость реакции (химическая кинетика)
Физические, химические и ядерные реакции протекают с разной скоростью. Химическая скорость - это количество изменений вещества в единицу времени. Скорость реакции = (изменение количества вещества) / время Δ [A (g)] - концепция изменения молярности газа A. Скорость реакции может быть записана для всех вопросов реакции.
Следующее уравнение показывает скорость реакции в пересчете на продукты и реагенты.
aA + bB → cC + dD
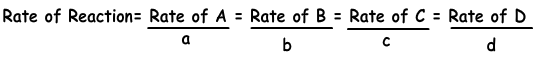
Энергия активации
Это энергия, необходимая для начала химической реакции. Реакции, имеющие более высокую энергию активации, имеют более низкую скорость реакции. Энергия активации может быть изменена только катализаторами. Они уменьшают энергию активации реакции и увеличивают скорость реакции. 
MnO2 является катализатором этой реакции.
Факторы, влияющие на скорость реакции
1. Типы вещества в реакции:
- Обычно реакции с реагентами и продуктами в газовых фазах имеют более высокую скорость реакции, чем реакции, состоящие из веществ в жидкой фазе.
- Разрыв слишком большого количества связей и образование новых замедляет реакцию.
- Реакции, состоящие из ионов, имеющих противоположные знаки, имеют высокую скорость реакции.
2. Концентрация вопросов в реакции:
Теория столкновений является наиболее успешной, которая объясняет химическую реакцию. Частицы должны сталкиваться, чтобы реагировать друг на друга. Наоборот, все столкновения не приводят к реакции.
- Вопросы должны были требовать энергии, чтобы реагировать.
- Частицы должны сталкиваться в соответствующей геометрии, чтобы реагировать.
Соотношение между концентрациями веществ и скоростью реакции можно объяснить так:
aA + bB → cC + dD
Скорость реакции этой реакции определяется путем;
Скорость реакции = к. [А]a.[B]b,
Где; k - константа скорости или коэффициент скорости, который зависит от температуры, а a и b - показатели степени.
Порядок реакции;
Порядок реакции - это сумма показателей. Например; Скорость реакции = к. [A]2. [B]. [C]3 порядок этой реакции 2 + 1 + 3 = 6.
3. Температура в реакциях:
Повышение температуры около 10 ° С приводит к увеличению скорости реакции. Когда мы повышаем температуру;
количество столкновений в единицу времени увеличивается
число частиц, имеющих энергию выше энергии активации, увеличивается.
4. Катализаторы:
Катализаторы - это вещества, которые увеличивают или уменьшают скорость реакции, и они не меняются в реакции. График, приведенный ниже, показывает влияние катализаторов на реакцию.
5. Поверхность реактивов:
Если размер частиц небольшой, то поверхность их увеличивается. Увеличивая поверхность реагентов, увеличивайте скорость реакции.