Химическое равновесие рабочий лист
Химическое равновесие рабочий лист
До сих пор мы узнали, что реакции происходят в одном направлении. Но сейчас мы имеем дело с обратимыми реакциями. Реакция, приведенная ниже, находится в закрытом контейнере;
A(g) + B(g) → C(g) + D(g)
В начале А реагирует с В и образует газы С и D. Это «прямая реакция », и скорость этой реакции записывается как;
Скорость реакции = kf. [A]. [B]
Поскольку концентрации A и B со временем уменьшаются, скорость прямой реакции также уменьшается. Кроме того, полученные молекулы C и D сталкиваются друг с другом и образуют молекулы A и B. Это называется «обратной реакцией », а скорость ее написана как;
Скорость реакции = kr. [C]. [D] kf / kr = константа равновесия и представлена с помощью Kc в виде концентрации. Константа равновесия следующей реакции записывается в виде;
aA + bB ↔ cC + dD
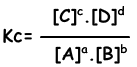
Гомогенное и гетерогенное равновесие
Если все вещества в равновесной реакции находятся в одной фазе, то это гомогенное равновесие, если хотя бы одно из веществ имеет другую фазу, то это гетерогенное равновесие. Когда мы пишем уравнение равновесия гетерогенного равновесия, мы не пишем чисто твердые и чисто жидкие вещества в уравнении равновесия.
CaCO3(s) ↔ CaO(s) + CO2(g)
Эта реакция является гетерогенной равновесной реакцией, и мы не записываем CaCO3 (s) и CaO (s) в уравнение равновесия.
Константа равновесия в терминах парциального давления
Концентрации газов прямо пропорциональны парциальному давлению их. Таким образом, мы можем записать константу равновесия в терминах парциальных давлений.
N2(g) + 3H2(g) ↔ 2NH3(g)
Константа равновесия этой реакции в пересчете на концентрации равна;
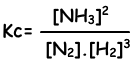
Константа равновесия этой реакции по парциальному давлению равна;
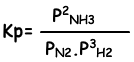
Факторы, влияющие на химическое равновесие
1. Влияние концентрации на равновесие:
Добавление или удаление веществ в равновесии эффекта реакции. Например, добавление реагентов или удаление продуктов увеличивает выход продукта. Напротив, добавление продуктов или удаление реагентов увеличивает выход реагентов. Другими словами, в первой ситуации равновесие смещается вправо, а во второй ситуации равновесие смещается влево.
2. Влияние температуры на равновесие:
- В эндотермической реакции; увеличение температуры сдвигает равновесие вправо и константа равновесия увеличивается.
- В эндотермической реакции; увеличение температуры сдвигает равновесие влево и константа равновесия уменьшается.
3. Влияние давления на равновесие:
- Если одно из веществ в контейнере при постоянной температуре и давлении будет удалено или добавлено, давление в системе изменится. Однако изменение концентрации принимается во внимание, а не давление.
- Температура может быть изменена при постоянном объеме. В этой ситуации, даже если давление изменяется, мы учитываем изменения температуры, находя константу равновесия.
- В газовых реакциях, если нет изменений числа молей, тогда давление не влияет на равновесие.