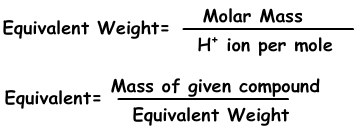Konzentration
Konzentration
Die Konzentration ist die Menge an gelöstem Stoff in der gegebenen Lösung. Wir können die Konzentration auf verschiedene Arten ausdrücken, z. B. in Prozent oder in Mol.
1) Konzentration in Prozent:
Es wird die Menge an gelöstem Stoff in 100 g Lösungsmittel gelöst. Wenn die Konzentration der Lösung 20% beträgt, gibt es nach unserem Verständnis 20 g gelösten Stoff in 100 g Lösung. 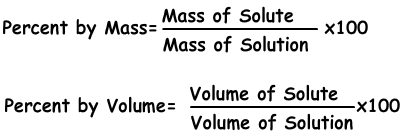
Beispiel: 10 g Salz und 70 g Wasser werden gemischt und eine Lösung hergestellt. Finden Sie die Konzentration der Lösung in Masseprozent.
Lösung:
Masse des gelösten Stoffes: 10 g
Masse der Lösung: 10 + 70 = 80 g
80 g Lösung enthalten 10 g gelösten Stoff
100 g Lösung enthalten X g gelösten Stoff
-——————————————
X=12,5 g %
Oder mit der Formel;
Massenprozent = 10.100 / 80 = 12,5%
Beispiel: Wenn die Massenkonzentration von 600 g NaCl-Lösung 40% beträgt, finden Sie in dieser Lösung die Menge des gelösten Stoffes.
Lösung:
100 g Lösung enthalten 40 g gelösten Stoff
600 g Lösung enthalten X g gelösten Stoff
-——————————————
X = 240 g NaCl-Salz löst sich in Lösung.
Beispiel: Wenn wir zu 160 g Lösung mit einer Konzentration von 20% 68 g Zucker und 272 g Wasser geben, finden Sie die Endkonzentration dieser Lösung.
Lösung:
Die Masse der Lösung beträgt 160 g vor der Zugabe von Zucker und Wasser.
100 g Lösung enthalten 20 g Zucker
160 g Lösung enthalten X g Zucker
-——————————————-
X = 32 g Zucker
Masse des gelösten Stoffes nach Zugabe = 32 + 68 = 100 g Zucker
Masse der Lösung nach Zugabe = 272 + 68 + 160 = 500 g
500 g Lösung enthalten 100 g Zucker
100 g Lösung enthalten X g Zucker
-——————————————
X = 20% ist die Konzentration der endgültigen Lösung.
2) Konzentration durch Mole:
Wir können die Konzentration von Lösungen in Molen ausdrücken. Die Anzahl der Mol pro Liter wird als Molarität bezeichnet und mit M angegeben. 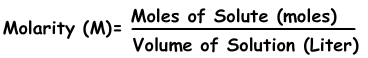
Beispiel: Mit 16 g NaOH werden 200 ml Lösung hergestellt. Welche der folgenden Aussagen trifft auf diese Lösung zu? (Die Molmasse von NaOH beträgt 40 g)
I. Die Konzentration der Lösung beträgt 2 Mol
II. Das Volumen des Wassers in Lösung beträgt 200 ml
III. Wenn wir der Lösung Wasser hinzufügen, nehmen die Molen des gelösten Stoffs ab.
Lösung: Mol NaOH
I. nNaOH = 16/40 = 0,4 Mol
V = 200 ml = 0,2 Liter
Molarität = 0,4 / 0,2 = 2 molar
I. ist wahr
II. Da das Volumen der Lösung 200 ml beträgt, ist das Wasservolumen kleiner als 200 ml. II ist falsch.
III. Wenn wir der Lösung Wasser hinzufügen, nimmt das Volumen der Lösung zu, aber die Mol des gelösten Stoffs ändern sich nicht.
Beispiel: 4,4 g XCl2-Salz lösen sich in Wasser und bilden 100 ml 0,4 molare XCl2-Lösung. Finden Sie die Molmasse von X. (Cl = 35)
Lösung:
Molarität = n / v n = M. V wobei V = 100 ml = 0,1 l und M = 0,4 molar ist
n=0,1.0,4=0,04 Mol
If 0,04 Mol XCl2 it 4,4 g
1 Mol XCl2 ist ? g
-———————————-
?=110 g XCl2
Molmasse von XCl 2 = X + 2. (35) = 110
X = 40 g / mol
3) Molalität:
Die Molalität ist ein weiterer Ausdruck der Konzentration von Lösungen. Es wird mit “m” bezeichnet und die Formel der Molalität ist;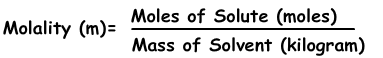
4) Normalität:
Wir können die Konzentration auf eine andere Weise mit Normalität ausdrücken, indem wir Äquivalente von gelösten Stoffen verwenden. 
Äquivalente können definiert werden als; Anzahl der Mol H+ Ionen in Säuren und OH- Ionen in Basenreaktionen. Zum Beispiel; 1 Mol H2SO4 ergibt 2H+ Ionen, das Äquivalent von H2SO4 ist 2. Wir finden das Äquivalentgewicht;