Atomare Struktur Prüfungen 3 und Problemlösungen
Atomare Struktur Prüfungen 3 und Problemlösungen
1. Gibt es eine sphärische Symmetrie im 6C Atom?
Lösung:
Elektronenkonfiguration von C; C: 1s22s22p2
Da das p Orbital 2 Elektronen enthält, gibt es in diesem Element keine sphärische Symmetrie. Um sphärische Symmetrieelemente zu haben, müssen sie gefüllte oder halb gefüllte Orbitale haben.
2. Weißer Phosphor und roter Phosphor sind Allotrope des Phosphorelements. Welche der folgenden Aussagen gelten für sie?
I. Elektronenstrukturen von Atomen sind unterschiedlich
II. Sie haben unterschiedliche Dichten
III. Die chemischen Eigenschaften der durch dieses Allotrop gebildeten Verbindung P2O5 sind unterschiedlich.
Lösung:
I. Allotrope Einschlussatome gehören zum selben Element. Die Elektronenstrukturen der Atome müssen also gleich sein. I ist falsch
II. Da Allotrope unterschiedliche physikalische Eigenschaften haben, müssen ihre Dichten unterschiedlich sein. II ist wahr.
III. Die chemischen Eigenschaften von Allotrop mit anderen Elementen sind gleich. III ist falsch.
3. Welche der folgenden Paare haben die gleichen chemischen Eigenschaften? (11H, 12D)
I. 2656Fe+2 und 2656Fe+3
II. 2656Fe und 2756Co
III. H2O und D2O
Lösung:
Um die gleichen chemischen Eigenschaften zu haben, müssen die Materien die gleiche Anzahl von Protonen und Elektronen haben.
I. Da sie die gleiche Anzahl von Protonen, aber eine unterschiedliche Anzahl von Elektronen haben, sind ihre chemischen Eigenschaften unterschiedlich.
II. Die Anzahl der Protonen und Neutronen ist unterschiedlich. Daher unterscheiden sich auch ihre chemischen Eigenschaften.
III. Sie haben die gleiche Anzahl von Protonen und Elektronen. Sie haben die gleichen chemischen Eigenschaften.
4. Welche der folgenden Aussagen sind für X und Y Atome falsch?
X: 1s22s22p63s1
Y: 1s22s22p63s23p64s1
I. Y ist der angeregte Zustand von X
II. X und Y sind Atome desselben Elements
III. Y ist stabiler als X
Lösung:
I. Die Elektronenkonfiguration von X wird gemäß dem Grundzustand des Atoms geschrieben. In Y wird jedoch ein Elektron von 3s in das 4s-Orbital geschrieben. Somit ist Y der angeregte Zustand von X. Wenn Energie an X abgegeben wird, kann daraus Y werden. I ist wahr.
II. Da beide 11 Elektronen haben, gehören sie zum selben Element. II ist wahr.
III. Da die Energie von X kleiner als die Energie von Y ist, ist sie stabiler als Y. III ist falsch.
5. Wenn die Anzahl der gefüllten Orbitale von X 7 ist und die Anzahl der halb gefüllten Orbitale 2 ist, welche der folgenden können gefunden werden?
I. Ordnungszahl
II. Anzahl der Valenzelektronen
III. Massenzahl
Lösung:
Wir zeichnen 7 gefüllte und 2 halb gefüllte Orbitale wie; 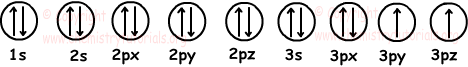
Elektronenkonfiguration: 1s22s22p63s23p4
Anzahl der Elektronen: 2 + 2 + 6 + 2 + 4 = 16
Im neutralen Atom ist die Anzahl der Elektronen gleich der Anzahl der Protonen und der Ordnungszahl. Unter Verwendung gegebener Daten können wir also die Ordnungszahl des Elements finden. Wir können auch Valenzelektronen eines Elements finden, indem wir sie addieren.
3p und 3s sind Valenzorbitale.
Anzahl der Valenzelektronen = 2 + 4 = 6
Wir müssen die Anzahl der Neutronen kennen, um die Massenzahl zu finden. Aus den angegebenen Daten können wir keine Massennummer ermitteln.
6. Welche der folgenden Aussagen gelten für 17X, 20Y und 18Z Elemente?
I. Y und X Elemente bilden eine YX2 Verbindung
II. Y- und Z+1 Ion sind isoelektronisch
III. Elektronenkonfiguration von Z+1 zuletzt mit 4s2 Orbital.
Lösung: 17X hat Elektronenkonfiguration: 1s22s22p63s23p5
20Y hat Elektronenkonfiguration: 1s22s22p63s23p64s2
X nimmt ein Elektron auf und Y gibt zwei Elektronen für die Edelgaselektronenkonfiguration. X ist nichtmetallisch und Y ist Metall, sie bilden folgende Verbindung;
YX2 I ist wahr
Da die Elektronenkonfiguration von Y und Z+1 unterschiedlich ist, sind sie nicht isoelektronisch. II ist falsch.
Z+1 hat eine Elektronenkonfiguration: 1s22s22p63s23p5
III ist falsch