Lösungs Spickzettel
Lösungs Spickzettel
Lösungen sind homogene Gemische aus zwei oder mehr als zwei Substanzen. Lösungen können in fester, flüssiger und gasförmiger Phase vorliegen. Lösungsmittel ist das Medium, in dem sich Materie löst, und gelöste Substanz ist die Materie, die sich in Lösungsmittel löst. Zum Beispiel ist Wasser in wässriger Zuckerlösung das Lösungsmittel, das Zucker löst, und Zucker ist der gelöste Stoff, der in Wasser gelöst wird.
Verdünnte Lösung: Lösungen mit einer geringen Menge an gelöstem Stoff im Lösungsmittel werden verdünnte Lösungen genannt.
Konzentrierte Lösung: Lösungen, in denen sich eine große Menge gelösten Stoffs in einem Lösungsmittel löst.
Solvation: Es ist der Prozess der Auflösung des gelösten Stoffes in Lösungsmittel.
Arten der Lösung:
1) Ionische Lösung: Wenn sich das Lösungsmittel in seine Ionen zersetzt, nennen wir diese Lösungen ionische Lösungen. Säuren, Basen und Salze produzieren ionische Lösungen.
2) Molekulare Lösung: Zersetzt sich eine Materie in ihre Moleküle, nennen wir diese Lösungen molekulare Lösungen . Die Auflösung von Zucker in Wasser ist ein Beispiel für die molekulare Solvatisierung.
Wir können Lösungen unter zwei Titeln nach ihrem Sättigungsverhältnis untersuchen; wie gesättigte Lösungen und ungesättigte Lösungen und übersättigte Lösungen.
1) Gesättigte Lösungen: Wenn die Lösung bei einer bestimmten Temperatur die maximale Menge an gelöstem Stoff auflöst, werden sie als gesättigte Lösungen bezeichnet. Bei dieser Art von Lösungen können sich feste Stoffe (ungelöst) am Boden des Tanks befinden.
2) Ungesättigte Lösungen: Wenn Lösungen bei bestimmten Temperaturen mehr gelöste Stoffe lösen können, werden sie als ungesättigte Lösungen bezeichnet. Wenn Sie einen Teil des Lösungsmittels verdampfen oder einen gelösten Stoff hinzufügen, können Sie gesättigte Lösungen herstellen.
3) Übersättigte Lösungen: Wenn Lösungen mehr gelösten Stoff als seine Kapazität enthalten, nennen wir diese Lösungen übersättigte Lösungen. Wir bereiten sie vor, indem wir die Lösung erhitzen und den gelösten Stoff hinzufügen, danach kühlen wir langsam die übersättigte Lösung ab. Sie können die Kristallisation von gelöstem Stoff in übersättigten Lösungen beobachten.
Löslichkeit und die Löslichkeit beeinflussende Faktoren
Die Löslichkeit ist die Menge an gelöstem Stoff in 100 cm³ (100 ml) Lösungsmittel.
Faktoren, die die Löslichkeit beeinflussen
Lösungsmittel und Arten des gelösten Stoffes, Temperatur, Druck und gemeinsamer Ioneneffekt sind Faktoren, die die Löslichkeit beeinflussen.
Faktoren, die die Lösungsgeschwindigkeit beeinflussen
- Arten von Materie
- Temperaturänderung (abnehmend für exotherme Lösungen und ansteigend für endotherme Lösungen)
- Kontaktoberfläche (Kristallzucker löst sich schneller als Würfelzucker)
- Das Mischen der Lösung erhöht die Solvatisierungsgeschwindigkeit.
Die Konzentration ist die Menge an gelöstem Stoff in der gegebenen Lösung. Wir können die Konzentration auf verschiedene Arten ausdrücken, z. B. in Prozent oder in Mol.
1) Konzentration in Prozent:
Es wird die Menge an gelöstem Stoff in 100 g Lösungsmittel gelöst. Wenn die Konzentration der Lösung 20% beträgt, gibt es nach unserem Verständnis 20 g gelösten Stoff in 100 g Lösung. 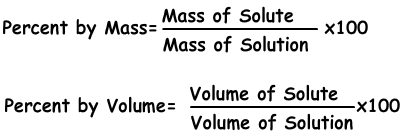
2) Konzentration durch Mole:
Wir können die Konzentration von Lösungen in Molen ausdrücken. Die Anzahl der Mol pro Liter wird als Molarität bezeichnet und mit M angegeben. 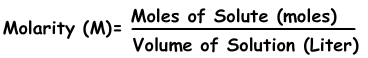
3) Molalität:
Die Molalität ist ein weiterer Ausdruck der Konzentration von Lösungen. Es wird mit “m” bezeichnet und die Formel der Molalität ist; 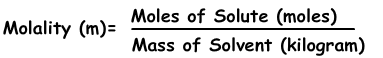
4) Normalität:
Wir können die Konzentration auf eine andere Weise mit Normalität ausdrücken, indem wir Äquivalente von gelösten Stoffen verwenden. 
Verdünnung und Dichte der Lösungen
Bei der Verdünnung wird Lösungsmittel zur Lösung gegeben. Da die Menge des gelösten Stoffes konstant bleibt, nimmt die Konzentration der Lösung ab. Wir finden die Beziehung zwischen der Konzentration der Lösungen vor und nach der Verdünnung mit der folgenden Formel:
M1.V1=M2.V2
Dabei ist M1 die anfängliche Molarität und M2 die endgültige Molarität und V1 und V2 sind anfängliche und endgültige Lösungsvolumina.
Um die Konzentration der Lösungen zu erhöhen, sollten Sie gelösten Stoff hinzufügen oder das Lösungsmittel aus der Lösung abdampfen. Die oben angegebene Formel wird auch zur Erhöhung der Konzentration von Lösungen verwendet;
M1.V1=M2.V2
Dichte der Lösungen
Wir finden die Lösungsdichte nach folgender Formel; 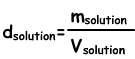
Ionenkonzentration mit Beispielen
- Siedepunkt, Gefrierpunkt, Dampfdruck und Eigenschaften wie die Dichte der Lösungen unterscheiden sich von den Eigenschaften des reinen Lösungsmittels. Beispielsweise siedet Wasser bei 100 ° C, während Salzwasserlösung über 100 ° C siedet.
- Wenn in Wasser gelöste Stoffe nicht flüchtig sind, verhindern sie das Verdampfen von Wasser, wodurch der Siedepunkt von Wasser steigt und der Gefrierpunkt von Wasser sinkt. Im Winter wird Salz auf die Straße gegossen, um den Gefrierpunkt des Wassers zu senken.
- In einer Lösung ist die Erhöhung des Siedepunkts direkt proportional zur molaren Konzentration der Teilchen in der Lösung.
- In flüssigen Lösungen ist die Abnahme der Gefrierpunkte und des Dampfdrucks umgekehrt proportional zur molaren Konzentration der Partikel in der Lösung.
- Die Leitfähigkeit von Elektrizität ist direkt proportional zur molaren Konzentration von Ionen in Lösungen. Zum Beispiel leiten Alkohol und Zucker keinen Strom.