Gase Prüfung 4 und Problemlösungen
Gase Prüfung 4 und Problemlösungen
1. Bestimmen Sie die Dichte von C4H8 bei einer Temperatur von 273 0C und einem Druck von 2 atm. (H = 1, C = 12)
Lösung:
T=273 + 273 = 546 0K
P=2atm und Molmasse von C4H8=4.(12) + 8(1)=56g/mol
Wir verwenden das ideale Gasgesetz, um die Dichte des Gases zu bestimmen.
P.MC4H8=d.R.T
2.56=d.0,082.546
d=2,5g/L
2. Wenn die Summe der Drücke von 1,6 g He und 0,8 g CH4-Gase 0,9 atm beträgt, finden Sie die Partialdrücke von He und CH4 (He = 4, C = 12, H = 1).
Lösung:
Mol Gase; nHe=1,6/4=0,4mol
nCH4=0,8/16=0,05mol
ntotal=0,4 + 0,05=0,45mol
Partialdrücke von Gasen werden durch die Formel gefunden;
Px=(nx/ntotal).Ptotal
PHe=0,4/0,45,0,0=0,8atm
PCH4=0,05/0,45.0,4=0,1atm
3. Es befindet sich He-Gas in einem bestimmten Behälter. Welche der folgenden Aussagen trifft für diesen Behälter bei konstanter Temperatur zu?

I. Wenn wir CH4-Gas in den Behälter geben, steigt der Partialdruck von He an.
II. Wenn wir O2 (g) in den Behälter geben, erhöht sich die Dichte der Gase im Behälter.
III. Wenn wir Ar-Gas in den Behälter geben, bleibt die durchschnittliche kinetische Energie konstant.
Lösung:
I. Die Zugabe von CH4 in den Behälter erhöht die Gesamtzahl der Mol, aber die Mol He ändert sich nicht, so dass der Partialdruck konstant bleibt. I ist falsch
II. Wenn wir O2 (g) in den Behälter geben, nimmt die Gesamtmasse der Gase zu, und da das Volumen konstant ist, nimmt die Dichte der Gase zu. II ist wahr.
III. Alle Gase haben bei gleicher Temperatur die gleiche durchschnittliche kinetische Energie. III ist wahr.
4. Welche der folgenden Aussagen gelten für CH4 und He, die im folgenden Bild angegeben sind?

I. Der Druck von CH4 und He ist gleich.
II. Die Anzahl der Kollisionen mit der Oberfläche der Einheit in der Zeiteinheit ist gleich.
III. Ihre Dichten sind gleich.
Lösung:
I. Da CH4 und He das gleiche Volumen, Temperatur und Mol haben, sind auch ihre Drücke gleich. I ist wahr
II. Die Anzahl der Kollisionen in der Zeiteinheit ist direkt proportional zur Geschwindigkeit der Gase. 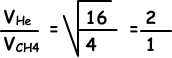
Die Geschwindigkeit von He ist größer als die Geschwindigkeit von CH4, daher ist die Anzahl der Kollisionen von He größer als die Anzahl der Kollisionen von CH4. II ist falsch.
III. Da die Molmassen von CH4 und He unterschiedlich sind, sind auch ihre Dichten unterschiedlich. III ist falsch.
5. In einem geschlossenen Behälter mit konstantem Volumen befindet sich ideales Gas. Welche der folgenden Grafiken gelten für dieses Gas? (P: Druck, T: Temperatur, d: Dichte)
Lösung:
I. Da die Anzahl der Mole und das Volumen des Gases konstant sind, erhöht eine zunehmende Temperatur den Druck. Ich bin wahr
II. P.V ist direkt proportional zu Temperatur und Molzahl. Da Mol Gas konstant ist und T zunimmt; P.V erhöht sich ebenfalls. II ist wahr.
III. Da die Anzahl der Mole, Volumen und Masse des Gases konstant sind; Dichte bleibt konstant. III ist wahr.