Elektronenkonfiguration mit Beispielen
Elektronenkonfiguration mit Beispielen
Elektronen sind nicht an festen Positionen in Atomen platziert, aber wir können ungefähre Positionen von ihnen vorhersagen. Diese Positionen werden als Energieniveaus oder Schalen von Atomen bezeichnet.
- Das niedrigste Energieniveau ist 1 und es wird mit der ganzen Zahl n = 1, 2, 3, 4, 5, 6 … oder Buchstaben beginnend von K, L, N bis Q bezeichnet. Ein Atom kann maximal 7 Energieniveaus haben und Elektronen können ändere ihr Level entsprechend ihrer Energie.
- Jedes Energieniveau hat eine andere Anzahl von Elektronen. Zum Beispiel können wir die Anzahl der Elektronen in vier Energieniveaus mit der folgenden Formel finden; 2n2.
- Energieniveau hat;
2n2=2.12=2 Elektronen
- Energieniveau hat;
2n2=2.22=8 Elektronen
- Energieniveau hat;
2n2=2.32=18 Elektronen
- Elektronen sind Energieniveaus, beginnend mit den ersten Energieniveaus. Wenn eines der Energieniveaus voll ist, werden Elektronen nach dem Energieniveau platziert.
Die folgenden Bilder zeigen die Position der Elektronen der Atome O und Mg.
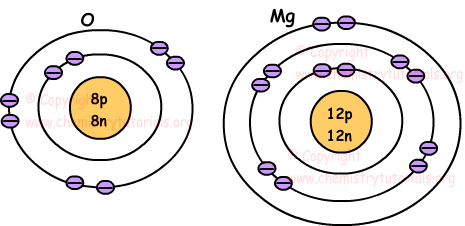
Die Anzahl der Elektronen an der äußeren Hülle des Atoms ergibt die folgende Klassifizierung.

Elektronenkonfiguration von Atom-Shows, Schalen, Unterschalen und Anzahl der Elektronen in Unterschalen. Wir untersuchen die Elektronenkonfiguration anhand der folgenden Beispiele.
Beispiel: Helium 2
1s2
Wo;
1 ist die Hauptquantenzahl oder das Energieniveau (Schale)
s ist die Unterebene oder Unterschale (Kapazität der Unterschale ist 2 Elektronen)
2 zeigt die Anzahl der Elektronen in der s-Unterschale
Beispiel: Chlor 17 1s22s22p63s23p5
Die Koeffizienten 1, 2, 2, 3 und 3 sind Energieniveaus von Cl. Wie Sie sehen können, kann die “p” Unterschale maximal 6 Elektronen haben.
Die Hochgestellten 2, 2, 6, 2 und 5 sind Elektronen in den Unterschalen “s” und “p”.
Beispiel: Brom 35
1s22s22p63s23p64s23d104p5
Wie Sie sehen können, kann die “d” -Unterschale maximal 10 Elektronen haben.
Beispiel: Tantal 73 1s22s22p63s23p64s23d104p65s24d105p66s24f145d3
Wie Sie sehen können, kann die Unterschale “f” maximal 14 Elektronen haben.