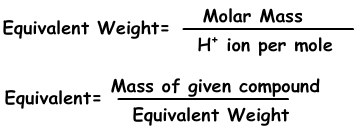Концентрация с примерами
Концентрация с примерами
Концентрация - это количество растворенного вещества в данном растворе. Мы можем выражать концентрацию по-разному, например, в процентах или в молях.
1) Концентрация в процентах:
Именно количество растворенного вещества растворяется в 100 г растворителя. Если концентрация раствора составляет 20%, мы понимаем, что в 100 г раствора содержится 20 г растворенного вещества. 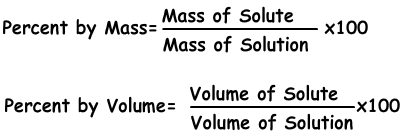
Пример: смешивают 10 г соли и 70 г воды и готовят раствор. Найти концентрацию раствора в процентах по массе.
Решение:
Масса растворенного вещества: 10 г
Масса раствора: 10 + 70 = 80 г
80 г раствора включает 10 г растворенного вещества
100 г раствора включает X г растворенного вещества
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯
Х = 12,5 г%
Или используя формулу;
Массовый процент = 10,100 / 80 = 12,5%
Пример: если концентрация по массе 600 г раствора NaCl составляет 40%, найдите количество растворенного вещества по массе в этом растворе.
Решение:
100 г раствора включает 40 г растворенного вещества
600 г раствора включает в себя X г растворенного вещества
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯
Х = 240 г соли NaCl растворяется в растворе.
Пример: если мы добавим 68 г сахара и 272 г воды к 160 г раствора с концентрацией 20%, определите конечную концентрацию этого раствора.
Решение:
Масса раствора до добавления 160 г сахара и воды.
100 г раствора включает 20 г сахара
160 г раствора включает в себя X г сахара
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯
Х = 32 г сахара
Масса растворенного вещества после добавления = 32 + 68 = 100 г сахара
Масса раствора после добавления = 272 +68 + 160 = 500 г
500 г раствора включает в себя 100 г сахара
100 г раствора включает в себя X г сахара
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯
Х = 20% - концентрация конечного раствора.
2) Концентрация по кроту:
Мы можем выразить концентрацию растворов по молям. Количество молей на литр называется «молярность », показанная с помощью M. 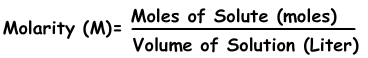
Пример: используя 16 г NaOH, готовят 200 мл раствора. Какие из следующих утверждений верны для этого решения? (Молярная масса NaOH составляет 40 г)
I. Концентрация раствора - 2 моль
II. Объем воды в растворе составляет 200 мл.
III. Если мы добавляем воду в раствор, количество растворенного вещества уменьшается.
Решение: моли NaOH
I. nNaOH = 16/40 = 0,4 моль
V = 200 мл = 0,2 литра
Молярность = 0,4 / 0,2 = 2 моль
I это правда
II. Поскольку объем раствора составляет 200 мл, объем воды меньше, чем 200 мл. II ложно.
III. Если мы добавляем воду в раствор, объем раствора увеличивается, но количество молей растворенного вещества не изменяется.
Пример: 4,4 г соли XCl2 растворяются в воде и образуют 100 мл 0,4-молярного раствора XCl2. Найти молярную массу X. (Cl = 35)
Решение:
Молярность = N / V
n = M.V, где V = 100 мл = 0,1 л и М = 0,4 моль
n = 0,1,0,4 = 0,04 моль
Если 0,04 моль XCl2 составляет 4,4 г
1 моль XCl2 есть? грамм
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯
? = 110 г XCl2
Молярная масса XCl2 = X + 2. (35) = 110
Х = 40 г / моль
3) моляльность:
Моляльность - это еще одно выражение концентрации растворов. Обозначается буквой «m», а формула моляльности: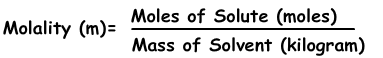
4) Нормальность:
Мы можем выразить концентрацию по-другому с нормальностью, используя эквиваленты растворенных веществ. 
Эквиваленты могут быть определены как; число молей иона H+ в кислотах и иона OH- в базовых реакциях. Например; 1 моль H2SO4 дает 2 H+ иона, эквивалент H2SO4 равен 2. Мы находим эквивалентный вес;